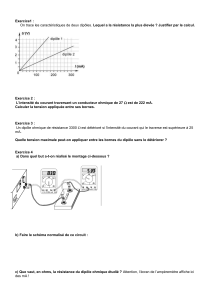
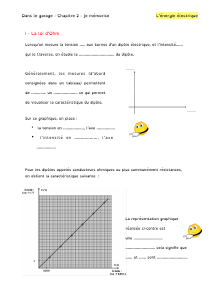
2
La biochimie est la chimie de la vie
Les organismes vivants peuvent être très différents mais partagent
néanmoins beaucoup de similarités aux niveaux cellulaire et
moléculaire :
-mêmes bases structurales : cellule(s), macromolécules, petites
molécules
-les réactions chimiques qui régulent l’activité des cellules sont
similaires
-l’information génétique est codée et exprimée de manière quasi-
identique
LA BIOCHIMIE
3
La Biochimie a pour but la compréhension complète, à
l'échelle moléculaire, de tous les aspects structuraux et
processus chimiques associés aux cellules.
La Biochimie est le language commum de toutes les sciences
biologiques.
Biochimie et médecine sont intimement liées : la première est
fondamentale pour comprendre les causes de maladies et élaborer
des traitements appropriés.
LA BIOCHIMIE
4
Rôle clé
Rôle clé dans le développement de molécules thérapeutiques
molécules thérapeutiques
Névirapine
5
Organisme pluricellulaire
Ensembles d’organes
Tissus
Cellules
~m
~cm
~mm
~µm
6
Composition d'une cellule
7
Rôles divers : catalyse,
défense, transporteur,
structure, …
Contiennent et transmettent
l’information génétique
Stockage de l’énergie
et élément de structure
au niveau des cellules
Stockage de l’énergie,
élément de structure
des membranes,
pigments, signaux
(27%)
Composition d'une cellule

8
Organisme pluricellulaire
Ensembles d’organes
Tissus
Cellules
Organites subcellulaires
Assemblées supramoléculaires
Macromolécules
~m
~cm
~mm
~µm
~µm
~nm
~nm
Molécules ~nm
9
Hierarchie structurale de l'organisation cellulaire
paroi
~µm ~nm
10
Macromolécules : polymères d’unités élémentaires
- Protéines : polymères d’acides aminés liés par liaisons
peptidiques (ou amides)
- Acides nucléiques : polymères de (désoxy)nucléotides associés
par liaisons phosphodiesters
- Polysaccharides : polymères d’unités glucidiques associées par
liaisons O-glycosidiques
Assemblées supramoléculaires
- Les lipides membranaires s'assemblent avec les protéines
membranaires pour former les membranes cellulaires (interactions
non-covalentes en jeu)
11
Hierarchie structurale de l'organisation cellulaire
Polymérisations par formation de LIAISONS COVALENTES :
Mn + M Mn+1 +H2O(condensation)
paroi
12
Une cellule transforme l'énergie et la matière
Pour ses besoins et grâce à de nombreuses réactions, une cellule :
- dégrade des nutriments (stockés ou ingérés) pour en extraire de
l'énergie (oxydation, hydrolyse)
- utilise de petites molécules organiques pour synthétiser des
molécules complexes (requérant de l'énergie ; réduction,
condensation)
13
Ces réactions sont organisées en séquences et désignées voies
métaboliques telles que :
A B C ....... P
Energie libre et e– sont capturés par des
transporteurs
Les voies métaboliques impliquant les constituants principaux
(protéines, ac. nucléiques, sucres et lipides) sont pratiquement
identiques chez tous les organismes.
A B C ....... P
Ensemble de réactions : métabolisme

14
Enz. 1
Enz. 3
Enz. 2
Enz. 4
A
B
C
D
Interactions
non-covalentes
Importance des interactions non-covalentes dans des
voies de synthèse ou de dégradation
15
Hierarchie structurale de l'organisation cellulaire
Structures moléculaires et interactions intermoléculaires
dictées par des INTERACTIONS NON-COVALENTES
paroi
16
Nous étudierons les structures des macromolécules suivantes
ainsi que leurs monomères constituants :
-les protéines (polymères d’acides aminés)
- les acides nucléiques ADN, ARN (polymères de nucléotides)
- les polysaccharides (polymères de sucres)
-les lipides membranaires
PLAN DU COURS
17
1. ATOMES ET LIAISONS
CHIMIQUES
18
Systématiquement, dans une molécule :
-Cfera 4 liaisons (sauf intermédiaires)
-Nfera 3 liaisons (si 4 alors chargé +, doublet partagé)
-Ofera 2 liaisons (si 3 alors chargé +, doublet partagé)
Les liaisons covalentes
19
Traduit la tendance d’un
atome à attirer vers lui les
électrons.
H, C, N, O, S, P
Électronégativité

20
X – Y
électronégativités ⇥
différentes (ex : O–H, N–H)
⇥égales ou proches
(ex : C–C ou C–H)
⇤+⇤–
déficit en e–e– équitablement
répartis sur X et Y
liaison polaire liaison apolaire
X Y
excédent en e–
La polarité d'une liaison est dictée par la
différence d'électronégativité
X Y
21
2. FONCTIONS ORGANIQUES
22
Les biomolécules comportent de nombreuses fonctions
Ex. : ATP, coenzyme A
ATP
23
Les alcanes
Ce sont les composés de formule générale CnH2n+2 .
Les liaisons C–C et C–H sont fortes (> 80 kcal/mol).
C–H quasiment pas polarisé, leur rupture est très difficile (à
basse T) et peu polarisable à l'approche de réactifs, même
chargés.
Font donc preuve d'une grande stabilité (même en présence
d'acides ou bases fortes, d'oxydants ou réducteurs forts).
24
Les alcools
Un alcool est un composé dans lequel un groupe hydroxyle OH
est lié à un carbone ; solubilité dans l'eau augmente (p/r alcane)
Souvent noté R–OH, avec R : groupe alkyle
Polyalcool : plusieurs groupes OH
Alcool insaturé : contient une ou plusieurs insaturations
ac. aminé
25
Caractéristiques de la fonction alcool
⇤+⇤'–
Deux liaisons polaires du fait de l'électro-
gativité de O
Deux doublets libres sur O
– C – O – H
⇤''+
L'oxydation d'un C peut être vue comme une perte de H ou un gain
de liaison(s) avec O :
Oxydation du C qui augmente ici :
R–CH3, R–CH2–OH, R–CH=O, R–COOH

26
Réactions
Alcool
Aldéhyde, cétone, ac. carboxylique
Alcène
Ester
oxydation
déshydratation
estérification
27
Les thiols
Les composés comportant le groupe –SH sont analogues aux
alcools : thiols ou mercaptans
Réactivité différente toutefois (due aux rayons différents)
- acidité marquée : formation de R–S–(thiolate : nucléophile)
- oxydation facile R–SH + R–SH (+ ½ O2) →R–S–S–R (+ H2O)
- grande importance dans l'”activation” des biomolécules par
formation d'un thioester : R–CO–S–CoA,C est “activé”
28
Les amines
Composés dans lesquels un atome N est lié à au moins un atome C
29
⇤+⇤'–
– C – N – H
⇤''+
Caractéristiques de la fonction amine
Deux liaisons polaires du fait de l'électro-
gativité de N
Un seul doublet libre ici sur N
⇥de N est plus faible que celle de O. Conséquences :
- disponibilité du doublet plus grande, basicité plus grande (p/r alcool)
- plus nucléophile, réagissent donc avec site C “déficitaire”
(électrophile)
- liaisons C–N et N–H très difficile à rompre
30
Les aldéhydes et cétones
Ils comportent un groupe carbonyle C=O :
-aldéhydes : R–CH=O
-cétones : R–CO–R'
sucres
31
Les aldéhydes et cétones
La liaison C=O est, dans les 2 cas, polarisée.
Réactions d'addition et de réduction notamment sur le C “déficitaire”
Lactate
déshydrogénase
 6
6
 7
7
 8
8
 9
9
1
/
9
100%