TRAVAUX PRATIQUES DE
GENETIQUE
(Semestre 4)
TP3
Année universitaire : 2018 - 2019
UNIVERSITE HASSAN II-
CASABLANCA
FACULTE DES SCIENCES BEN M’SIK
Département de Biologie

2
La Drosophile :
CARACTERISTIQUES ET TECHNIQUES DE
MANIPULATIONS
La drosophile, Drosophila melanogaster, ou mouche du vinaigre est un insecte diptère de
petite taille (4 mm environ). C’est un insecte cosmopolite, répandu dans le monde entier par
l’activité humaine. Vu son chimiotactisme positif vis-à-vis de l’acide acétique, la drosophile
utilise comme milieu naturel les fruits en décomposition.
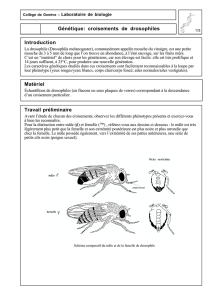
I. Morphologie générale de l’adulte :
Les caractères morphologiques de l’adulte ont l’avantage d’être précis, simples et
relativement faciles à identifier objectivement à l’aide de la loupe binoculaire. En utilisant
comme référence la souche sauvage de phénotype connu, on peut déterminer toute variation
brusque (mutation) affectant ces caractères chez une souche inconnue. De ce fait, il est important
de connaître de façon précise la morphologie de la souche sauvage (Figure 1).
Le corps de la drosophile est recouvert de soies (microsoies et macrosoies) et divisé en trois
parties :
• La tête reliée au thorax par un cou étroit, porte :
- Deux gros yeux à facettes de couleur rouge brique,
- Trois ocelles dans la région frontale,
- Deux antennes courtes, épaisses et tri-articulées : l’article terminal porte un appendice appelé
arista
- Deux pièces buccales formant une trompe.
• Le thorax comprend des métamères ou segments :
- Le prothorax, peu développée et invisible dorsalement, porte la première paire de pattes,
- Le mésothorax, bien visible dorsalement, porte les ailes et la deuxième paire de pattes,
- Le métathorax, invisible dorsalement, porte les balanciers et la troisième paire de pattes
• L’abdomen est segmenté et orné de soies, chaque segment présent dorsalement une bande
postérieure pigmentée en noir. Les pièces génitales sont visibles ventralement.

3
Figure 1 : Morphologie de la drosophile (Drosophila melanogaster) adulte.
Figure 2 : Dimorphisme sexuel : présence de ‘‘peignes sexuels’’ chez le mâle.
C : coxa ; TR : trochanter ; F : fémur ; TI : tibia ; TA : tarse.
Tête
Thorax
Abdomen

4
II. Le dimorphisme sexuel :
Les mâles et les femelles présentent des différences morphologiques (Figure 1) que l’on peut
voir à l’œil nu ou à la loupe binoculaire :
1- Différence de taille : les femelles sont plus grandes que les mâles.
2- Différence dans la forme et la couleur de l’abdomen : vu dorsalement, l’abdomen de la
femelle est plus pointu avec des segments terminaux gris assez clairs ; l’abdomen du
mâle, plus arrondi, a des segments terminaux gris très foncé, voire noirs.
3- Différence au niveau des organes sexuels : le pénis est très coloré en brun à brun foncé
alors que la plaque vaginale ne l’est pas.
4- Présence de ‘‘peignes sexuels’’ chez le mâle seulement (Figure 2) : il s’agit d’une touffe
de poils noirs au niveau du métatarse (premier article du tarse de la paire de pattes
antérieures). Ce critère est particulièrement utilisé lorsque la différence de coloration ou
de forme de l’abdomen entre mâles et femelles n’est pas clairement perceptible (individus
à peine éclos, mutants de coloration du corps, mutants plus ou moins déformés).
III. Cycle de développement et biologie sexuelle :
La phase diploïde est prédominante : la phase haploïde est réduite aux gamètes.
Figure 3 : Cycle de développement de Drosophila melanogaster
Le temps nécessaire pour que l’œuf fécondé donne un individu adulte (ou imago) varie en
fonction de la température d’élevage. A titre d’exemple, les adultes émergent à partir :

5
▪ Du 50ème jour à 12°C.
▪ Du 33ème jour à 14°C.
▪ Du 19ème jour à 19°C.
▪ Du 10ème jour au 11ème jour à 25-26°C.
▪ Du 8ème jour à 30°C
Ces chiffres ne sont pas absolus : il peut y avoir une légère variabilité d’un repiquage à un
autre pour une même souche : par ailleurs, un certain nombre de mutations conduisent à un
allongement du cycle de développement.
Les œufs sont blancs, opaques, avec 2 petites ‘‘cornes’’, les larves sont jaunâtres,
translucides, mangent beaucoup et se déplacent activement.
Les mâles n’ont pas d’activité sexuelle pendant à peu près 9 heures après leur émergence.
Par ailleurs, l’éthérisation les inactive pendant environ un jour.
Les femelles, elles, ne peuvent être fécondées pendant les 4 premières heures qui suivent leur
émergence (présence d’un ‘‘bouchon vaginal”). Elles ne commencent à pondre qu’un jour après
leur émergence avec une période de ponte maximale se situant à peu près au 4ème jour.
Après copulation, les spermatozoïdes peuvent être stockés dans le réceptacle séminal et les
spermathéques de la femelle : les œufs sont fécondés à leur passage dans l’utérus avant la ponte.
De ce fait, il est impératif d’utiliser les femelles vierges lors de croisement entre souches de
génotypes différents. Une seule femelle peut donner une descendance de 200 individus. Une
femelle vierge pond des œufs en chapelet qui ne se développent pas.
IV. Garniture chromosomique :
Drosophila melanogaster possède 4 paires de chromosomes répertoriés comme suit :
• Une paire de chromosomes sexuels X (ou I) et Y (mâle : XY ; femelle : XX)
• Trois paires d’autosomes : II, III et IV
De très nombreux gènes sont localisés sur le chromosome X, II et III. Sur le chromosome IV,
très petit, de très rares gènes sont localisés. Quelques gènes (situés dans des régions proches du
centromère) sont communs aux chromosomes X et Y.
Il n’y a pas de crossing-over chez le mâle, quelle que soit la paire de chromosomes.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%