Chap. IV Réactions entre l’acide chlorhydrique et les métaux.
I. Comment savoir si une solution est acide basique ou neutre ?
Qu’est-ce que le pH (potentiel hydrogène) ?
Le pH, est une valeur (un nombre) comprise entre 0 et 14,
il sert à mesurer le taux d’acidité d’une solution.
Remarque : Le pH est une valeur qui n’a pas d’unité.
_ Lorsque le pH = 7, la solution est neutre.
_ Lorsque le pH < 7, la solution est acide.
Plus le pH est petit, plus la solution est acide.
_ Lorsque le pH > 7, la solution est basique.
Plus le pH est grand, plus la solution est basique.
--------------------------------------------------- Fin séance 1 ---------------------------------------------
II. Particules responsables de l’acidité et de la basicité.
A. Les ions hydrogène et les ions Hydroxyde.
L’acidité d’une solution est due à la présence d’un type d’ions : les ions hydrogène H+.
La basicité d’une solution est due à la présence d’un type d’ions : les ions hydroxyde
HO-.
Remarque :
_ Une solution neutre contient autant d’ions hydrogène H+ que d’ions hydroxyde HO-.
_ Une solution acide contient beaucoup plus d’ions hydrogène H+ que d’ions hydroxyde
HO-.
_ Une solution basique contient beaucoup plus d’ions hydroxyde HO- que d’ions
hydrogène H+.
B. Effet de la dilution sur l’acidité ou la basicité d’une solution.
Lorsqu’on dilue une solution acide (on ajoute de l’eau), le pH augmente et se rapproche
de 7, la solution devient de moins en moins acide.
Lorsqu’on dilue une solution basique, le pH diminue et se rapproche de 7, la solution
devient de moins en moins basique.
--------------------------------------------------- Fin séance 3 ---------------------------------------------
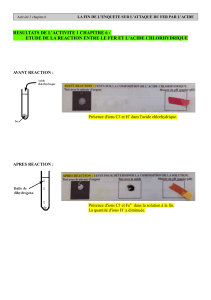
III. Action de l’acide chlorhydrique sur le fer.
L’acide chlorhydrique réagit avec le fer pour former du dihydrogène une solution de
chlorure de fer II.
Les réactifs sont l’acide chlorhydrique et le fer.
Les produits sont le dihydrogène et le chlorure de fer II.

Définition d’une réaction chimique.
Une transformation est appelée une réaction chimique lorsque les produits
obtenus sont différents des réactifs de départ.
IV. Utilisation d’une équation bilan pour décrire une transformation.
A. Les règles de conservation à respecter
Règle de la conservation de la matière.
_ Lors d’une réaction chimique, on ne peut ni créer ni détruire les atomes.
_ Conséquence : il y a donc autant d’atomes de chaque type des 2 côtés de la
flèche de l’équation bilan.
Règle de la conservation de la charge électrique.
_ Lors d’une réaction chimique, on ne peut ni créer ni détruire les électrons.
_ Conséquence : la somme totale des charges électriques est la même des 2 côtés de
la flèche de l’équation bilan.
--------------------------------------------------- Fin séance 5 ---------------------------------------------
B. Équation bilan de la réaction entre l’acide chlorhydrique et le fer.
L’acide chlorhydrique réagit avec le fer pour former du dihydrogène et chlorure de fer II.
ions hydrogène + fer dihydrogène + ions fer II
H+ + Fe H2 + Fe2+
1atome de fer 1 atome de fer
1 atome d’hydrogène 2 atomes d’hydrogène
1 charge positive 2 charges positives
2H+ + Fe H2 + Fe2+
1atome de fer 1 atome de fer
2 atome d’hydrogène 2 atomes d’hydrogène
2 charges positives 2 charges positives
--------------------------------------------------- Fin séance 7 ---------------------------------------------
1
/
2
100%