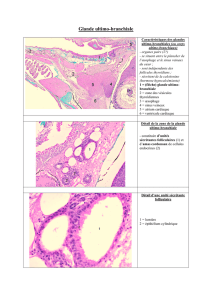
La glande lacrymale est d`origine ectodermique par son épithélium

UNIVERSITE MOHAMMED V
FACULTE DE MEDECINE ET DE PHARMACIE -RABAT-
ANNEE: 200 THESE N°: 161
L
LE
ES
S
T
TU
UM
ME
EU
UR
RS
S
E
EP
PI
IT
TH
HE
EL
LI
IA
AL
LE
ES
S
P
PR
RI
IM
MI
IT
TI
IV
VE
ES
S
D
DE
E
L
LA
A
G
GL
LA
AN
ND
DE
E
l
la
ac
cr
ry
ym
ma
al
le
e
C
CH
HE
EZ
Z
L
L'
'A
AD
DU
UL
LT
TE
E
THESE
Présentée et soutenue publiquement le :………………………..
PAR
Mme. Nouama SHIMI
Née le 24 Avril 1983 à Kénitra
Pour l'Obtention du Doctorat en
Médecine
MOTS CLES Tumeurs – Lacrymale – Radiologie – Histologie – Biopsie - Orbitotomie.
JURY
Mme. R. DAOUDI PRESIDENT
Professeur d'Ophtalmologie
Mr. My. Z.. BENCHERIF RAPPORTEUR
Professeur d'Ophtalmologie
Mme. L.O. CHERKAOUI
Professeur d'Ophtalmologie
Mr. E.H. ABDELLAH
Professeur Agrégé d'Ophtalmologie
JUGES

D
Dé
éd
di
ic
ca
ac
ce
es
s

~
~
A
A
M
Me
es
s
P
Pa
ar
re
en
nt
ts
s
~
~
‡
‡
A
A
m
mo
on
n
P
Pè
èr
re
e
H
Ho
om
mm
me
e
d
d’
’u
un
ne
e
g
gr
ra
an
nd
de
eu
ur
r
r
ra
ar
ri
is
ss
si
im
me
e,
,
s
se
en
ns
si
ib
bl
le
e,
,
a
at
tt
te
en
nt
ti
if
f,
,
h
ho
on
nn
nê
êt
te
e,
,
e
et
t
p
po
os
ss
sé
éd
da
an
nt
t
u
un
n
g
gr
ra
an
nd
d
c
cœ
œu
ur
r
e
en
n
o
or
r,
,
t
tu
u
n
no
ou
us
s
a
as
s
t
ta
an
nt
t
a
ap
pp
pr
ri
is
s
p
pa
ar
r
l
la
a
c
co
on
nd
du
ui
it
te
e
a
av
va
an
nt
t
l
le
es
s
m
mo
ot
ts
s,
,
p
pa
ar
r
l
le
e
s
sé
ér
ri
ie
eu
ux
x,
,
l
l’
’é
éd
du
uc
ca
at
ti
io
on
n,
,
l
la
a
r
ri
ig
gu
ue
eu
ur
r,
,
l
la
a
s
si
in
nc
cé
ér
ri
it
té
é,
,
q
qu
u’
’e
es
st
t
c
ce
e
q
qu
ue
e
c
c’
’e
es
st
t
q
qu
ue
e
l
le
es
s
b
bo
on
nn
ne
es
s
m
ma
an
ni
iè
èr
re
es
s,
,
l
le
es
s
n
no
ob
bl
le
es
s
v
ve
er
rt
tu
us
s,
,
e
et
t
l
le
es
s
v
vo
oi
ie
es
s
i
id
dé
éa
al
le
es
s
à
à
e
em
mp
pr
ru
un
nt
te
er
r.
.
T
Tu
u
a
a
s
sa
ac
cr
ri
if
fi
ié
é
t
to
ou
ut
t
t
to
on
n
t
te
em
mp
ps
s,
,
t
tu
u
t
tr
ra
av
va
ai
il
ll
lé
é,
,
d
du
ur
re
em
me
en
nt
t
e
et
t
r
ru
ud
de
em
me
en
nt
t,
,
p
po
ou
ur
r
q
qu
ue
e
t
ta
a
f
fa
am
mi
il
ll
le
e
n
ne
e
m
ma
an
nq
qu
ue
e
d
de
e
r
ri
ie
en
n
e
et
t
s
so
oi
it
t,
,
e
en
n
p
pe
er
rm
ma
an
ne
en
nc
ce
e,
,
h
he
eu
ur
re
eu
us
se
e
g
gr
râ
âc
ce
e
à
à
t
ta
a
p
pr
ré
és
se
en
nc
ce
e
e
et
t
à
à
t
to
on
n
d
dé
év
vo
ou
ue
em
me
en
nt
t.
.
C
C’
’e
es
st
t,
,
e
en
n
f
fa
ai
it
t,
,
e
en
n
s
s’
’i
in
ns
sp
pi
ir
ra
an
nt
t
d
de
e
t
ta
a
d
dé
ét
te
er
rm
mi
in
na
at
ti
io
on
n,
,
t
to
on
n
c
co
ou
ur
ra
ag
ge
e,
,
t
te
es
s
f
fa
ac
cu
ul
lt
té
és
s
à
à
a
af
ff
fr
ro
on
nt
te
er
r
l
la
a
v
vi
ie
e
e
et
t
à
à
m
ma
aî
ît
tr
ri
is
se
er
r
s
se
es
s
r
re
eb
bo
on
nd
di
is
ss
se
em
me
en
nt
ts
s,
,
q
qu
ue
e
n
no
ou
us
s
a
av
vo
on
ns
s
a
ap
pp
pr
ri
is
s
à
à
ê
êt
tr
re
e
s
sû
ûr
rs
s
d
de
e
n
no
ou
us
s,
,
c
co
on
nf
fi
ia
an
nt
ts
s
e
en
n
n
no
os
s
d
de
es
st
ti
in
né
ée
es
s,
,
e
et
t
e
en
nc
co
or
re
e
p
pl
lu
us
s
c
cr
ro
oy
ya
an
nt
ts
s
q
qu
ua
an
nt
t
à
à
l
la
a
r
ré
éa
al
li
is
sa
at
ti
io
on
n
d
de
e
n
no
os
s
r
rê
êv
ve
es
s
e
et
t
n
no
os
s
a
as
sp
pi
ir
ra
at
ti
io
on
ns
s.
.
T
Te
es
s
c
co
on
ns
se
ei
il
ls
s,
,
s
si
i
v
va
al
le
eu
ur
re
eu
ux
x,
,
f
fo
on
nd
dé
és
s
e
et
t
é
ép
pr
ro
ou
uv
vé
és
s
o
on
nt
t
é
ét
té
é
c
ce
e
f
fa
an
na
al
l
a
ay
ya
an
nt
t
g
gu
ui
id
dé
é
m
me
es
s
p
pa
as
s,
,
f
fo
or
rt
ti
if
fi
ié
é
m
me
es
s
t
tr
ré
éb
bu
uc
ch
he
em
me
en
nt
ts
s
e
et
t
r
ra
as
ss
su
ur
ré
é
m
me
es
s
i
in
nc
ce
er
rt
ti
it
tu
ud
de
es
s.
.
G
Gr
râ
âc
ce
e
à
à
t
to
oi
i,
,
à
à
t
te
es
s
e
en
nc
co
ou
ur
ra
ag
ge
em
me
en
nt
ts
s
e
et
t
t
te
es
s
a
ap
pp
pl
la
au
ud
di
is
ss
se
em
me
en
nt
ts
s,
,
j
j’
’a
ai
i
v
vu
u
n
na
aî
ît
tr
re
e
e
en
n
m
mo
oi
i
l
la
a
c
ce
er
rt
ti
it
tu
ud
de
e,
,
l
la
a
f
fo
oi
i,
,
l
la
a
c
cr
ro
oy
ya
an
nc
ce
e,
,
l
la
a
m
mo
od
de
es
st
ti
ie
e,
,
l
l’
’a
am
mo
ou
ur
r
e
et
t
l
le
e
r
re
es
sp
pe
ec
ct
t.
.
‡
‡
A
A
m
ma
a
M
Mè
èr
re
e
F
Fo
oy
ye
er
r
d
de
e
l
la
a
c
ch
ha
al
le
eu
ur
r,
,
d
de
e
l
la
a
t
te
en
nd
dr
re
es
ss
se
e
e
et
t
d
de
e
l
l’
’a
am
mo
ou
ur
r
s
sa
an
ns
s
b
bo
or
rn
ne
es
s
n
ni
i
e
em
mp
ph
ha
as
se
e,
,
t
tu
u
e
es
s
u
un
ne
e
p
pe
er
rl
le
e,
,
u
un
n
e
ex
xe
em
mp
pl
le
e
é
éd
di
if
fi
ia
an
nt
t
d
de
e
l
l’
’a
af
ff
fe
ec
ct
ti
io
on
n,
,
d
de
e
l
l’
’a
at
tt
te
en
nt
ti
io
on
n,
,
d
de
e
l
la
a
g
gé
én
né
ér
ro
os
si
it
té
é,
,
d
de
e
l
la
a
f
fi
id
dé
él
li
it
té
é
à
à
a
ac
cc
co
om
mp
pl
li
ir
r
t
te
es
s
t
tâ
âc
ch
he
es
s,
,
à
à
p
pr
re
en
nd
dr
re
e
s
so
oi
in
n
d
de
e
t
te
es
s
e
en
nf
fa
an
nt
ts
s,
,
à
à
l
le
es
s
c
co
om
mb
bl
le
er
r
d
de
e
t
te
es
s
v
ve
er
rt
tu
us
s,
,
d
de
e
t
ta
a
s
sa
ag
ge
es
ss
se
e,
,
d
de
e
t
ta
a
s
si
im
mp
pl
li
ic
ci
it
té
é
e
et
t
d
de
e
l
la
a
g
gr
ra
an
nd
de
eu
ur
r
d
de
e
t
to
on
n
e
es
sp
pr
ri
it
t.
.
N
Nu
ul
ls
s
h
ho
om
mm
ma
ag
ge
es
s
n
ni
i
e
en
nc
co
or
re
e
d
de
e
r
re
em
me
er
rc
ci
ie
em
me
en
nt
ts
s
n
ne
e
s
se
er
ro
on
nt
t
e
en
n
m
me
es
su
ur
re
e
d
d’
’é
ég
ga
al
le
er
r
n
ne
e
s
se
er
ra
ai
it
t-
-c
ce
e
q
qu
ue
e
t
ta
an
nt
t
s
so
oi
it
t
p
pe
eu
u
c
ce
es
s
s
sa
ac
cr
ri
if
fi
ic
ce
es
s
q
qu
ue
e
t
tu
u
a
a
c
co
on
ns
se
en
nt
ti
is
s
à
à
m
mo
on
n
é
ég
ga
ar
rd
d
a
ai
in
ns
si
i
q
qu
u’
’à
à
c
ce
el
lu
ui
i
d
de
e
t
te
es
s
a
au
ut
tr
re
es
s
e
en
nf
fa
an
nt
ts
s.
.
T
To
on
n
r
re
eg
ga
ar
rd
d
r
ri
ic
ch
he
e,
,
r
re
em
mp
pl
li
i
d
d’
’a
am
mo
ou
ur
r
e
et
t
c
ca
ar
re
es
ss
sa
an
nt
t
e
es
st
t
u
un
ni
iq
qu
ue
e
v
vo
oi
ir
re
e
e
ex
xc
ce
ep
pt
ti
io
on
nn
ne
el
l
i
in
ns
sp
pi
ir
re
e
m
ma
a
f
fo
oi
i,
,
r
re
en
no
ou
uv
ve
el
ll
le
e
m
me
es
s
f
fo
or
rc
ce
es
s
e
et
t
r
ra
as
ss
sé
ér
rè
èn
ne
e
m
me
es
s
t
te
er
rg
gi
iv
ve
er
rs
sa
at
ti
io
on
ns
s.
.
J
Je
e
n
ne
e
s
sa
au
ur
ra
ai
is
s
t
te
e
r
re
em
me
er
rc
ci
ie
er
r
p
po
ou
ur
r
t
to
ou
ut
t
c
ce
e
q
qu
ue
e
t
tu
u
f
fa
ai
is
s
p
po
ou
ur
r
n
no
ou
us
s
e
et
t
j
je
e
p
pr
ri
ie
e
D
Di
ie
eu
u
p
po
ou
ur
r
q
qu
u’
’i
il
l
t
t’
’a
ac
cc
co
or
rd
de
e
t
to
ou
ut
t
l
le
e
b
bo
on
nh
he
eu
ur
r,
,
t
to
ou
ut
te
e
l
la
a
s
sa
an
nt
té
é
e
et
t
t
te
e
c
co
ou
uv
vr
re
e
d
de
e
t
to
ou
ut
te
e
S
Sa
a
B
Bé
én
né
éd
di
ic
ct
ti
io
on
n.
.

‡
‡
A
A
m
mo
on
n
M
Ma
ar
ri
i
C
Ce
et
tt
te
e
m
mo
od
de
es
st
te
e
d
dé
éd
di
ic
ca
ac
ce
e
n
n’
’e
es
st
t,
,
e
en
n
v
vé
ér
ri
it
té
é,
,
q
qu
u’
’u
un
n
t
té
ém
mo
oi
ig
gn
na
ag
ge
e
q
qu
ui
i
e
es
ss
sa
ay
ye
e
d
de
e
r
re
en
nd
dr
re
e
h
ho
om
mm
ma
ag
ge
e
à
à
l
la
a
p
pa
at
ti
ie
en
nc
ce
e,
,
d
do
on
nt
t
t
tu
u
a
as
s
f
fa
ai
it
t
p
pr
re
eu
uv
ve
e,
,
t
to
ou
ut
t
a
au
u
l
lo
on
ng
g
d
de
es
s
a
an
nn
né
ée
es
s
d
de
e
n
no
ot
tr
re
e
m
ma
ar
ri
ia
ag
ge
e.
.
T
Tu
u
m
m’
’a
as
s
é
ét
té
é
d
d’
’u
un
n
s
so
ou
ut
ti
ie
en
n
i
in
nd
dé
éf
fe
ec
ct
ti
ib
bl
le
e,
,
d
d’
’u
un
n
a
ap
pp
pu
ui
i
i
in
nc
co
om
mm
me
en
ns
su
ur
ra
ab
bl
le
e
e
et
t
s
su
ur
rt
to
ou
ut
t
d
d’
’u
un
n
s
se
ec
co
ou
ur
rs
s
i
in
né
ép
pu
ui
is
sa
ab
bl
le
e.
.
T
Te
es
s
o
or
ri
ie
en
nt
ta
at
ti
io
on
ns
s
s
si
i
p
pr
ré
éc
ci
ie
eu
us
se
es
s
e
et
t
s
si
i
c
co
on
ns
st
tr
ru
uc
ct
ti
iv
ve
es
s
m
m’
’o
on
nt
t
é
ét
té
é
g
gr
ra
an
nd
de
em
me
en
nt
t
u
ut
ti
il
le
es
s
e
et
t
r
ra
as
ss
su
ur
ré
é
m
me
es
s
h
hé
és
si
it
ta
at
ti
io
on
ns
s
l
lo
or
rs
s
d
de
e
m
me
es
s
m
mo
om
me
en
nt
ts
s
d
de
e
d
di
if
ff
fi
ic
cu
ul
lt
té
é.
.
M
Me
er
rc
ci
i
p
po
ou
ur
r
t
to
ou
us
s
c
ce
es
s
i
in
ns
st
ta
an
nt
ts
s
d
di
if
ff
fi
ic
ci
il
le
es
s
q
qu
ue
e
t
tu
u
a
as
s
s
su
u
e
en
nj
jo
ol
li
iv
ve
er
r,
,
t
to
ou
us
s
c
ce
es
s
h
he
eu
ur
re
es
s
d
de
e
b
bo
on
nh
he
eu
ur
r
d
do
on
nt
t
t
tu
u
m
m’
’a
as
s
f
fa
ai
it
t
p
pr
ro
of
fi
it
te
er
r
e
et
t
p
po
ou
ur
r
t
to
ou
us
s
l
le
es
s
e
ef
ff
fo
or
rt
ts
s
q
qu
ue
e
t
tu
u
a
as
s
d
dé
ép
pl
lo
oy
yé
és
s
p
po
ou
ur
r
a
as
ss
su
ur
re
er
r
m
mo
on
n
a
as
sc
ce
en
ns
si
io
on
n.
.
‡
‡
A
A
m
mo
on
n
F
Fr
rè
èr
re
e
M
Mo
oh
ha
am
me
ed
d
M
Ma
a
r
ré
éf
fé
ér
re
en
nc
ce
e
d
de
ep
pu
ui
is
s
t
to
ou
uj
jo
ou
ur
rs
s,
,
m
mo
on
n
m
mo
od
dè
èl
le
e,
,
t
tu
u
e
es
s
c
ce
et
tt
te
e
p
pe
er
rs
so
on
nn
ne
e
à
à
l
la
aq
qu
ue
el
ll
le
e
j
je
e
d
do
oi
is
s
é
én
no
or
rm
mé
ém
me
en
nt
t,
,
t
tu
u
a
as
s
i
in
ns
su
uf
ff
fl
lé
é
t
ta
a
d
dé
ét
te
er
rm
mi
in
na
at
ti
io
on
n
à
à
a
al
ll
le
er
r
d
de
e
l
l’
’a
av
va
an
nt
t
e
en
n
m
mo
oi
i,
,
t
te
es
s
p
pr
ro
op
pr
re
es
s
s
su
uc
cc
cè
ès
s
o
on
nt
t
é
ét
té
é
m
mi
ie
en
ns
s,
,
e
et
t
j
j’
’a
ai
i
f
fa
ai
it
t
d
de
e
t
te
es
s
d
di
ir
re
ec
ct
ti
iv
ve
es
s
u
un
n
a
ar
rs
se
en
na
al
l,
,
u
un
n
b
bo
ou
uc
cl
li
ie
er
r
e
et
t
u
un
ne
e
m
ma
an
nn
ne
e
d
de
e
c
co
on
nn
na
ai
is
ss
sa
an
nc
ce
es
s
q
qu
ui
i
m
m’
’o
on
nt
t
t
ta
an
nt
t
s
se
er
rv
vi
i
e
et
t
q
qu
ui
i
m
me
e
s
se
er
rv
ve
en
nt
t
e
en
nc
co
or
re
e.
.
J
Je
e
t
ti
ie
en
ns
s,
,
à
à
t
tr
ra
av
ve
er
rs
s
c
ce
et
tt
te
e
d
dé
éd
di
ic
ca
ac
ce
e,
,
à
à
t
te
e
r
re
em
me
er
rc
ci
ie
er
r
p
po
ou
ur
r
l
le
e
s
si
im
mp
pl
le
e
f
fa
ai
it
t
q
qu
ue
e
d
de
ep
pu
ui
is
s
m
mo
on
n
e
en
nf
fa
an
nc
ce
e
t
tu
u
a
as
s
t
to
ou
uj
jo
ou
ur
rs
s
é
ét
té
é
m
ma
a
p
pr
ro
op
pr
re
e
s
so
ou
ur
rc
ce
e
d
de
e
m
mo
ot
ti
iv
va
at
ti
io
on
n,
,
d
d’
’é
én
ne
er
rg
gi
ie
e
e
et
t
d
de
e
r
ré
és
so
ol
lu
ut
ti
io
on
n.
.
T
Tu
u
m
m’
’a
as
s
t
to
ou
uj
jo
ou
ur
rs
s
c
co
om
mb
bl
lé
é
d
de
e
t
ta
a
p
pr
ro
ot
te
ec
ct
ti
io
on
n
s
si
i
s
si
in
ng
gu
ul
li
iè
èr
re
e.
.
J
Je
e
r
re
em
me
er
rc
ci
ie
e,
,
e
en
n
l
la
a
c
ci
ir
rc
co
on
ns
st
ta
an
nc
ce
e,
,
D
Di
ie
eu
u
d
d’
’a
av
vo
oi
ir
r
é
éc
cl
la
ai
ir
ré
é
m
mo
on
n
e
es
sp
pr
ri
it
t
p
po
ou
ur
r
e
em
mp
pr
ru
un
nt
te
er
r
u
un
ne
e
v
vo
oi
ie
e
s
si
im
mi
il
la
ai
ir
re
e
à
à
l
la
a
t
ti
ie
en
nn
ne
e
e
et
t
p
po
ou
ur
r
a
av
vo
oi
ir
r
a
ad
do
op
pt
té
é
u
un
n
c
ch
he
em
mi
in
n
i
id
de
en
nt
ti
iq
qu
ue
e
à
à
c
ce
el
lu
ui
i
q
qu
ue
e
t
tu
u
a
as
s
c
ch
ho
oi
is
si
i
p
po
ou
ur
r
h
ho
on
no
or
re
er
r,
,
d
de
e
l
la
a
m
ma
an
ni
iè
èr
re
e
l
la
a
p
pl
lu
us
s
n
no
ob
bl
le
e,
,
l
le
e
n
no
om
m
d
de
e
n
no
ot
tr
re
e
f
fa
am
mi
il
ll
le
e
e
et
t
r
ré
éc
co
om
mp
pe
en
ns
se
er
r,
,
d
de
e
l
la
a
m
ma
an
ni
iè
èr
re
e
l
la
a
p
pl
lu
us
s
d
dé
év
vo
ou
ué
ée
e,
,
l
le
es
s
é
én
no
or
rm
me
es
s
s
sa
ac
cr
ri
if
fi
ic
ce
es
s
c
co
on
ns
se
en
nt
ti
is
s
p
pa
ar
r
n
no
os
s
p
pa
ar
re
en
nt
ts
s.
.
‡
‡
A
A
m
me
es
s
S
Sœ
œu
ur
rs
s
S
So
ou
um
mi
ia
a,
,
H
Ha
an
na
an
ne
e,
,
e
et
t
L
Lo
ou
ub
bn
na
a
M
Me
es
s
c
co
om
mp
pl
li
ic
ce
es
s,
,
m
me
es
s
a
am
mi
ie
es
s
e
et
t
m
me
es
s
c
co
on
nf
fi
id
de
en
nt
te
es
s,
,
a
av
ve
ec
c
l
le
es
sq
qu
ue
el
ll
le
es
s
j
j’
’a
ai
i
p
pa
ar
rt
ta
ag
gé
é
c
ch
ha
aq
qu
ue
e
j
jo
ou
ur
r
d
de
e
m
ma
a
v
vi
ie
e
e
et
t
a
au
ux
xq
qu
ue
el
ll
le
es
s
j
je
e
p
po
or
rt
te
e
u
un
n
a
am
mo
ou
ur
r
s
si
i
p
pr
ro
of
fo
on
nd
d
e
et
t
p
pl
lu
us
s
q
qu
ue
e
f
fr
ra
at
te
er
rn
ne
el
l.
.
V
Vo
ou
us
s
m
m’
’a
av
ve
ez
z
v
vu
u
g
gr
ra
an
nd
di
ir
r
e
et
t
v
vo
ou
us
s
m
m’
’a
av
ve
ez
z
s
so
ou
ut
te
en
nu
u
d
du
ur
ra
an
nt
t
t
to
ou
ut
te
es
s
m
me
es
s
a
an
nn
né
ée
es
s
d
d’
’é
ét
tu
ud
de
es
s
a
av
ve
ec
c
c
ce
et
t
e
es
sp
pr
ri
it
t
d
de
e
s
so
ol
li
id
da
ar
ri
it
té
é,
,
d
de
e
s
so
ou
ut
ti
ie
en
n
m
mo
or
ra
al
l
e
et
t
d
d’
’a
ap
pp
pu
ui
i
a
af
ff
fe
ec
ct
ti
if
f.
.
G
Gr
râ
âc
ce
e
à
à
v
vo
os
s
c
co
on
nt
tr
ri
ib
bu
ut
ti
io
on
ns
s
i
in
nd
di
iv
vi
id
du
ue
el
ll
le
es
s
q
qu
ue
e
j
je
e
s
su
ui
is
s
d
de
ev
ve
en
nu
ue
e
c
ce
e
q
qu
ue
e
j
je
e
s
su
ui
is
s,
,
p
pr
ré
és
se
en
nt
te
em
me
en
nt
t.
.
L
Le
es
s
m
mo
ot
ts
s
s
so
on
nt
t
i
in
nc
ca
ap
pa
ab
bl
le
es
s
d
d’
’e
ex
xp
pr
ri
im
me
er
r
c
ce
et
tt
te
e
r
re
ec
co
on
nn
na
ai
is
ss
sa
an
nc
ce
e
q
qu
ue
e
j
j’
’é
ép
pr
ro
ou
uv
ve
e
à
à
v
vo
ot
tr
re
e
é
ég
ga
ar
rd
d.
.
V
Vo
ou
us
s
ê
êt
te
es
s
l
le
es
s
s
sœ
œu
ur
rs
s
l
le
es
s
p
pl
lu
us
s
a
ag
gr
ré
éa
ab
bl
le
es
s
d
du
u
m
mo
on
nd
de
e,
,
l
le
es
s
p
pl
lu
us
s
r
re
em
ma
ar
rq
qu
ua
ab
bl
le
es
s
e
et
t
l
le
es
s
p
pl
lu
us
s
a
ad
do
or
ra
ab
bl
le
es
s.
.
‡
‡
A
A
m
ma
a
B
Be
el
ll
le
e
S
Sœ
œu
ur
r
:
:
L
Le
ei
il
la
a
e
et
t
l
le
e
p
pe
et
ti
it
t
A
Ah
hm
me
ed
d

U
Un
n
v
vé
ér
ri
it
ta
ab
bl
le
e
c
ca
ad
de
ea
au
u
d
du
u
c
ci
ie
el
l,
,
u
un
n
e
ex
xe
em
mp
pl
le
e
p
pr
re
es
sq
qu
ue
e
p
pa
ar
rf
fa
ai
it
t
d
de
e
l
la
a
f
fe
em
mm
me
e
r
ré
éu
us
ss
si
ie
e,
,
t
tu
u
a
as
s
é
ét
té
é
p
po
ou
ur
r
m
mo
on
n
f
fr
rè
èr
re
e
c
ce
et
tt
te
e
l
la
am
mp
pe
e
q
qu
ui
i
a
a
é
éc
cl
la
ai
ir
ré
é
l
le
es
s
s
se
en
nt
ti
ie
er
rs
s
d
de
e
s
so
on
n
e
ex
xi
is
st
te
en
nc
ce
e.
.
N
No
ou
us
s,
,
a
ai
in
ns
si
i
q
qu
ue
e
n
no
ot
tr
re
e
f
fr
rè
èr
re
e,
,
s
so
om
mm
me
es
s
t
tr
rè
ès
s
h
he
eu
ur
re
eu
ux
x
d
de
e
t
t’
’a
av
vo
oi
ir
r
p
pa
ar
rm
mi
i
n
no
ou
us
s,
,
e
et
t
m
mo
oi
i,
,
e
en
n
p
pa
ar
rt
ti
ic
cu
ul
li
ie
er
r,
,
j
je
e
t
ti
ie
en
ns
s
à
à
t
te
e
r
re
em
me
er
rc
ci
ie
er
r
p
po
ou
ur
r
c
ce
e
q
qu
ue
e
t
tu
u
r
re
ep
pr
ré
és
se
en
nt
te
es
s,
,
p
po
ou
ur
r
c
ce
et
tt
te
e
s
sy
ym
mp
pa
at
th
hi
ie
e
s
si
in
nc
cè
èr
re
e
e
et
t
s
si
in
ng
gu
ul
li
iè
èr
re
e
q
qu
ue
e
t
tu
u
p
po
or
rt
te
es
s
e
en
n
t
to
oi
i
e
et
t
d
do
on
nt
t
t
tu
u
f
fa
ai
is
s
p
pr
ro
of
fi
it
te
er
r
t
to
on
n
e
en
nt
to
ou
ur
ra
ag
ge
e.
.
J
Je
e
v
vo
ou
us
s
s
so
ou
uh
ha
ai
it
te
e,
,
a
ai
in
ns
si
i
q
qu
u’
’à
à
m
mo
on
n
f
fr
rè
èr
re
e
p
pl
le
ei
in
n
d
de
e
b
bo
on
nh
he
eu
ur
r
e
et
t
u
un
ne
e
p
pr
ro
og
gé
én
ni
it
tu
ur
re
e
d
de
es
s
p
pl
lu
us
s
f
fo
or
rm
mi
id
da
ab
bl
le
es
s
à
à
l
l’
’i
in
ns
st
ta
ar
r,
,
s
si
in
no
on
n
m
mi
ie
eu
ux
x,
,
d
de
e
c
ce
e
p
pe
et
ti
it
t
j
jo
oy
ya
au
ux
x
q
qu
u’
’e
es
st
t
A
Ah
hm
me
ed
d
d
do
on
nt
t
l
le
e
s
so
ou
ur
ri
ir
re
e,
,
i
in
nn
no
oc
ce
en
nt
t
e
et
t
a
an
ng
gé
él
li
iq
qu
ue
e,
,
r
ra
ay
yo
on
nn
ne
e
d
de
e
p
pl
lu
us
s
e
en
n
p
pl
lu
us
s.
.
‡
‡
A
A
m
ma
a
c
co
ou
us
si
in
ne
e
R
Ra
ac
ch
hi
id
da
a
L
La
ac
ch
hk
ka
ar
re
e
N
Nu
ul
ll
le
e
d
dé
éd
di
ic
ca
ac
ce
e
n
ne
e
s
se
er
ra
ai
it
t
à
à
l
la
a
h
ha
au
ut
te
eu
ur
r
p
po
ou
ur
r
r
re
en
nd
dr
re
e
h
ho
om
mm
ma
ag
ge
e
o
ou
u
e
en
nc
co
or
re
e
r
ré
éc
co
om
mp
pe
en
ns
se
er
r
l
la
a
n
na
at
tu
ur
re
e
p
pr
ré
éc
ci
ie
eu
us
se
e
d
de
e
t
te
es
s
c
co
on
ns
se
ei
il
ls
s,
,
d
de
e
t
to
on
n
a
at
tt
te
en
nt
ti
io
on
n
e
et
t
d
de
e
t
to
on
n
a
as
ss
si
is
st
ta
an
nc
ce
e,
,
ô
ô
c
co
om
mb
bi
ie
en
n
i
in
nd
di
is
sp
pe
en
ns
sa
ab
bl
le
e.
.
I
Il
l
n
n’
’e
es
st
t
n
nu
ul
ll
le
em
me
en
nt
t
p
pr
ré
ét
te
en
nt
ti
ie
eu
ux
x
d
d’
’a
af
ff
fi
ir
rm
me
er
r
q
qu
ue
e
c
ce
e
t
tr
ra
av
va
ai
il
l
n
n’
’a
au
ur
ra
ai
it
t
j
ja
am
ma
ai
is
s
v
vu
u
l
le
e
j
jo
ou
ur
r
s
sa
an
ns
s
t
to
oi
i,
,
s
sa
an
ns
s
t
ta
a
g
gé
én
né
ér
ro
os
si
it
té
é
d
d’
’e
es
sp
pr
ri
it
t
o
ou
u
e
en
nc
co
or
re
e
t
te
es
s
d
di
ir
re
ec
ct
ti
iv
ve
es
s
l
le
es
s
p
pl
lu
us
s
p
pe
er
rt
ti
in
ne
en
nt
te
es
s.
.
T
Tu
u
a
as
s
t
to
ou
uj
jo
ou
ur
rs
s
é
ét
té
é,
,
e
et
t
t
tu
u
l
le
e
s
se
er
ra
ai
is
s
e
en
nc
co
or
re
e,
,
m
mo
on
n
m
mo
od
dè
èl
le
e
e
et
t
m
ma
a
r
ré
éf
fé
ér
re
en
nc
ce
e.
.
D
De
e
m
mê
êm
me
e,
,
q
qu
ue
e
t
tu
u
e
es
s
c
ce
et
tt
te
e
m
ma
an
nn
ne
e
i
in
né
ép
pu
ui
is
sa
ab
bl
le
e
d
de
e
m
mo
ot
ti
iv
va
at
ti
io
on
n,
,
d
de
e
m
mo
od
de
es
st
ti
ie
e
e
et
t
d
d’
’a
as
ss
su
ur
ra
an
nc
ce
e,
,
a
au
up
pr
rè
ès
s
d
de
e
l
la
aq
qu
ue
el
ll
le
e
j
je
e
n
ne
e
c
ce
es
ss
se
er
ra
ai
i
d
de
e
s
so
ol
ll
li
ic
ci
it
te
er
r
c
co
on
ns
se
ei
il
l
e
et
t
p
pu
ui
is
se
er
r
r
re
ec
co
om
mm
ma
an
nd
da
at
ti
io
on
n.
.
E
En
nf
fi
in
n,
,
q
qu
uo
oi
iq
qu
ue
e
j
je
e
d
di
is
se
e
o
ou
u
q
qu
uo
oi
iq
qu
ue
e
j
je
e
f
fa
as
ss
se
e,
,
j
je
e
n
ne
e
s
sa
au
ur
ra
ai
is
s
t
te
e
r
re
em
me
er
rc
ci
ie
er
r
a
as
ss
se
ez
z
p
po
ou
ur
r
t
to
ou
ut
t
c
ce
e
q
qu
ue
e
t
tu
u
a
as
s
f
fa
ai
it
t
p
po
ou
ur
r
m
mo
oi
i,
,
t
to
ou
ut
t
a
au
u
l
lo
on
ng
g
d
de
e
l
la
a
c
co
on
nc
ce
ep
pt
ti
io
on
n
d
de
e
c
ce
e
t
tr
ra
av
va
ai
il
l,
,
e
et
t
t
to
ou
ut
t
a
au
u
l
lo
on
ng
g
d
de
e
m
mo
on
n
c
cu
ur
rs
su
us
s
s
sc
co
ol
la
ai
ir
re
e.
.
‡
‡
A
A
m
ma
a
t
ta
an
nt
te
e
F
Fa
at
ti
im
ma
a
S
Sh
hi
im
mi
i
e
et
t
s
so
on
n
é
ép
po
ou
ux
x
J
Je
e
t
ti
ie
en
ns
s
à
à
t
tr
ra
av
ve
er
rs
s
c
ce
et
tt
te
e
d
dé
éd
di
ic
ca
ac
ce
e
à
à
v
vo
ou
us
s
e
ex
xp
pr
ri
im
me
er
r
m
me
es
s
r
re
em
me
er
rc
ci
ie
em
me
en
nt
ts
s
l
le
es
s
p
pl
lu
us
s
v
vi
if
fs
s
e
et
t
l
le
es
s
p
pl
lu
us
s
c
ch
ha
al
le
eu
ur
re
eu
ux
x
p
po
ou
ur
r
t
to
ou
ut
t
l
le
e
s
so
ou
ut
ti
ie
en
n
d
do
on
nt
t
v
vo
ou
us
s
a
av
ve
ez
z
f
fa
ai
it
t
m
mo
on
nt
tr
re
e
à
à
m
mo
on
n
é
ég
ga
ar
rd
d
e
et
t
p
po
ou
ur
r
t
to
ou
us
s
l
le
es
s
s
se
en
nt
ti
im
me
en
nt
ts
s
l
le
es
s
p
pl
lu
us
s
s
si
in
nc
cè
èr
re
es
s
d
do
on
nt
t
v
vo
ou
us
s
a
av
ve
ez
z
t
té
ém
mo
oi
ig
gn
né
é
à
à
m
mo
on
n
a
ad
dr
re
es
ss
se
e.
.
‡
‡
A
A
m
ma
a
g
gr
ra
an
nd
d-
-m
mè
èr
re
e
H
Hn
ni
ia
a
P
Pa
ar
r
l
le
e
b
bi
ia
ai
is
s
d
de
e
c
ce
es
s
t
te
en
nd
dr
re
es
s
m
mo
ot
ts
s,
,
j
je
e
t
te
e
f
fa
ai
is
s
m
me
es
s
s
si
ig
gn
ne
es
s
d
de
e
r
ré
év
vé
ér
re
en
nc
ce
e
l
le
es
s
p
pl
lu
us
s
s
si
in
nc
cè
èr
re
es
s
e
et
t
j
je
e
p
pr
ri
ie
e
D
Di
ie
eu
u,
,
e
en
n
l
la
a
c
ci
ir
rc
co
on
ns
st
ta
an
nc
ce
e,
,
d
de
e
t
t’
’a
ac
cc
co
or
rd
de
er
r,
,
d
da
av
va
an
nt
ta
ag
ge
e,
,
d
de
e
l
lo
on
ng
gu
ue
e
v
vi
ie
e,
,
d
de
e
b
bo
on
nh
he
eu
ur
r,
,
d
de
e
s
sa
an
nt
té
é
e
et
t
d
de
e
b
bé
éa
at
ti
it
tu
ud
de
e.
.
‡
‡
‡
‡
‡
‡
‡
‡
A
A
m
me
es
s
b
be
ea
au
ux
x
p
pa
ar
re
en
nt
ts
s
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
1
/
204
100%