TH1 Activité 5 : « Boire en toute sécurité »
Vous disposez de trois solutions incolores dans des flacons, notées A,B et C. Seule l'une d'entre
elle est une eau minérale. Les deux autres sont des solutions d'eau sucrée et d'eau salée.
Vous disposez des réactifs et du matériel suivants :
d'une solution toxique contenant des ions chlorure Cl- et des ions baryum Ba2+
une solution contenant des ions oxalates C2O42- et des ions ammonium NH4+
d'un générateur elc, de tiges de carbone, de pinces crocodiles, d’un porte électrode, de fils
de connexion, d'un ampèremètre, un bécher, 2 tubes à essais notés 1 et 2.
Votre mission 1 : Identifier la solution d'eau sucrée sans utiliser de réactifs .
(Il est rigoureusement interdit de goûter les solutions)
Votre mission 2 : Identifer l'eau minérale à l'aide d'un seul même test d’identification sur les
deux solutions restantes.

Mission 1 : Retrouvons la solution d’eau sucrée
- Quelle propriété distingue la solution d’eau sucrée des deux autres solutions ?
Justifier (docs 1, 3)
……………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………
- Schémas normalisés de l’expérience à réaliser permettant d ‘identifier l’eau sucrée :
- Mise en commun des résultats :
Solution A
IA = ……………… mA
Solution B
IB = ……………… mA
Solution C
IC = ……………… mA
- Conclure à la mission 1 :

Noms et prénoms
TP act.4 : COMPTE RENDU
« BOIRE EN TOUTE SECURITE » MISSION2
Note : /20
Maintenant que l’on a éliminé la solution d’eau sucrée, on doit retrouver quelle est la solution
d’eau salée et la solution d’eau minérale dont l’étiquette est donnée doc.5.
Mission 2 : Retrouvons la solution minérale parmis les deux solutions en UN SEUL TEST
- Entourer les formules d’ions que vous pouvez identifier grâce à un test qui vous est donné
sur la fiche méthode :
Ca2+, Mg2+, Na+, K+, Cl-, NO3-, SO42-, HCO3-
- Maintenant à l’aide de la liste de matériel à votre disposition et en tenant compte
des risques pour votre santé, indiquer le nom et la formule du SEUL ion que vous allez
choisir de mettre en évidence pour distinguer l’eau minérale de l’eau salée :
………………………………………………
- Nom et Formule de la solution test à utiliser : ………………………………………….…………………………
- Sachant que des charges de signe contraires s’attirent, quel est l’ion réactif testeur
dans la solution test :
……………………….………………………………………………………….……………………………
- Légender le test à réaliser sur les deux solutions pouvant être de l’eau minérale
APPELER LE PROFESSEUR POUR VALIDATION
Tube 1 Tube 2
Solution :……………..
Solution :………….
Solution test
Ion réactif testeur : ………
ANA
Elaboration
d’un
protocole
A
B
C
D

- En prenant toutes mes mesures de sécurité en compte, réaliser le test DEVANT LE
PROFESSEUR :
- Résultat obtenu lorsque le test est positif :
………………………………………………………………………
- Nom et formule de l’ion mis en évidence par ce test :
………………………………………………………
- Conclure à la mission 2 :
Conclusion: Qu’à-t-on appris sur les eaux minérales ?
REA
Tests
d’identification
A
B
C
D
ANA
Interprétation
et conclusion
A
B
C
D
APP
Prise en
compte
sécurité
A
B
C
D

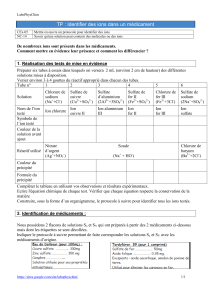
Une fiche méthode : comment identifier des ions en solution par des tests d’identification ?
Pour tester la présence d’un ion dans une solution, on ajoute un « réactif spécifique» capable de réagir avec cet ion.
Si on observe la formation d’un précipité (= solide au sein d’un liquide), le test est positif : l’ion recherché est présent.
Protocole des tests :
Tests de reconnaissance de quelques CATIONS métalliques :
Cation métallique
recherché
Cu2+
Fe2+
Fe3+
Réactif testeur utilisé
Ion hydroxyde HO-
d’une solution d’hydroxyde de sodium
(La soude est très corrosive).
Ports de gants lunettes et blouse obligatoire
En cas de test positif,
apparition d’un précipité…
Bleu
Vert foncé
Rouille
Test de reconnaissance de l’ion CALCIUM Ca2+ ,de l’ANION CHLORURE Cl– et l’anion sulfate SO42-:
Ion recherché
Ion calcium Ca2+
Ion chlorure Cl-
Ion sulfate SO42-
Réactif testeur
utilisé
Ion C2O42- d’une
solution d’oxalate
d’ammonium
Ion Ag+ d’une
solution de nitrate
d’argent produit
corrosif et dangereux
pour l’environnement
Ion baryum Ba2+d’une
solution de chlorure de
baryum toxique
En cas de test
positif,
apparition d’un
précipité…
Blanc
Blanc
On verse environ 2 mL de la solution
contenant l’ion à tester dans un tube à essais.
On ajoute quelques gouttes de la
solution contenant le réactif de cet ion.
Y a-t-il formation d’un
précipité ? Ne pas agiter pour
mieux observer !
Réactif de l’ion
recherché
 6
6
1
/
6
100%