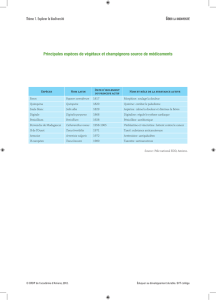
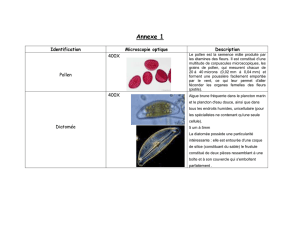
Thèse : Caractérisation des champignons par spectroscopie
Telechargé par
Antoine THIERRY

Année 2013 N°
UNIVERSITE DE REIMS CHAMPAGNE-ARDENNE
ECOLE DOCTORALE SCIENCES TECHNOLOGIE SANTE
THESE
Présentée pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE DE REIMS CHAMPAGNE-ARDENNE
Discipline : Biologie-Biophysique
Soutenue publiquement le 02/12/2013
Par
Aurélie LECELLIER
Née le 18 mars 1983 à Issy les Moulineaux
Titre :
Caractérisation et identification des champignons
filamenteux par spectroscopie vibrationnelle
JURY
Président : Dr. Jérôme MOUNIER (Brest, France)
Rapporteurs : Pr. Boualem SENDID (Lille, France)
Pr. Olivier SIRE (Vannes, France)
Examinateurs : Dr. Wilfried ABLAIN (Rennes, France)
Dr. Caroline AMIEL (Caen, France)
Pr. Michel MANFAIT (Reims, France)
Directeurs de thèse : Pr. Ganesh SOCKALINGUM (Reims, France)
Dr. Dominique TOUBAS (Reims, France)

«Le rôle de l’infiniment petit est infiniment grand. »
Louis Pasteur

Remerciements
1
Remerciements
A Messieurs le Professeur Michel Manfait et le Professeur Olivier Piot,
Je vous remercie sincèrement pour m’avoir accueillie et pour m’avoir permis de réaliser ce travail au
sein de votre unité que vous avez dirigée successivement lors de ces trois années de thèse. Je vous suis
très reconnaissante pour m’avoir donné l’occasion de présenter mon travail dans des congrès
nationaux et internationaux.
A Monsieur le Professeur Boualem Sendid,
Je vous suis très reconnaissante d’avoir accepté d’être rapporteur de cette thèse, je vous remercie pour
votre participation au Jury de soutenance et pour l’intérêt que vous avez porté à mon travail.
A Monsieur le Professeur Olivier Sire,
Je vous suis très reconnaissante d’avoir accepté d’être rapporteur de cette thèse, je vous remercie pour
votre participation au Jury de soutenance et pour l’intérêt que vous avez porté à mon travail.
A Monsieur le Docteur Wilfried Ablain,
Je vous remercie sincèrement d’avoir accepté de faire partie du Jury de soutenance. Je vous
remercie également pour votre contribution à l’élaboration de ce travail.
A Madame le Docteur Caroline Amiel,
Je vous exprime toute ma reconnaissance de m’avoir initié à la spectroscopie vibrationnelle lors de
mon passage au sein de votre équipe pour y effectuer mon stage de Master 2 ainsi que pour avoir
guidé mes premiers pas dans le monde de la recherche. Je vous remercie pour votre soutien et vos
encouragements que vous m’avez apporté. Je n’oublie pas que c’est grâce à vous si j’ai pu réaliser
cette thèse. Cela me fait extrêmement plaisir que vous ayez accepté d’examiner mon travail et de me
faire l’honneur de participer au Jury de soutenance.
A Monsieur le Professeur Michel Manfait,
Je vous adresse mes remerciements les plus respectueux pour avoir accepté d'être membre du Jury de
soutenance. Je vous remercie pour l'intérêt que vous avez porté à ce travail, ainsi que pour votre
sympathie.

Remerciements
2
A Monsieur le Docteur Jérôme Mounier,
Je tiens à t’exprimer toute ma gratitude pour l’aide précieuse que tu m’as apporté tout au long de cette
thèse et ainsi que pour ta disponibilité malgré la distance. Je te remercie pour ton implication dans ce
projet, pour tes conseils avisés et ta sympathie à mon égard. Enfin, je te remercie énormément pour
m’avoir fait l’honneur de participer au Jury de soutenance.
A Monsieur le Professeur Ganesh Sockalingum,
Je vous suis sincèrement reconnaissante d’avoir encadré ce travail de thèse. Je vous remercie pour la
confiance que vous m’avez accordée pendant ces trois années et pour avoir cru en mes capacités
tout au long de ce travail. Je vous remercie pour tous vos conseils stimulants, votre patience, ainsi que
pour la gentillesse que vous avez manifestée à mon égard. J'ai beaucoup apprécié travailler à vos
côtés tant sur le plan scientifique que sur le plan humain. Je garde toujours beaucoup de
plaisir à discuter avec vous et à bénéficier de votre expérience.
A Madame le Docteur Dominique Toubas,
Je vous adresse mes plus sincères remerciements pour votre encadrement durant cette thèse. Je suis
ravie d’avoir travaillé en votre compagnie tout au long de ces années durant lesquelles j’ai pu
apprécier vos qualités tant pédagogiques et scientifiques qu’humaines. Je vous remercie également
pour votre disponibilité, ainsi que pour votre aide et vos précieux conseils que vous m’avez apportés
lors de l’élaboration de cette thèse. Pour tout ce que vous m'avez appris, je vous remercie très
sincèrement.
A Monsieur le Docteur Vincent Gaydou,
Je te remercie sincèrement pour toute l’aide que tu m’as apportée durant ma dernière année de thèse.
L’aboutissement de ce travail est le fruit de la complémentarité de nos compétences respectives. Je te
remercie pour ton soutien et tes encouragements ainsi que pour ta patience.

Remerciements
3
A Monsieur le Docteur Jayakrupakar Nalalla,
Nuvvu naku chesina prathi daniki am forever gratefull to you. Nenu neku eppatiki runapadiuntanu.
Nevichina encouragement, advices ki chala thanks. Nrnnu opikaga vinnaduku neku ela thanks
cheppalo ardam avvatledu. Nuvvu naa work environment ni fun environment ga marchavu with your
humor. Mana madhyalo oka viluvaina sambandham erpadindi. Mana projects aipoiundochu kani mana
friendship will last forever.
Je tiens à remercier également :
Stéphane Huet et Nadia Leden pour leur collaboration au sein de ce projet. Les discussions que nous
avons pu avoir lors des réunions de projets m’ont beaucoup apporté.
L’équipe Médian et plus particulièrement : Céline, Christophe, Cyril, David, Denise Pisani, Goutam,
Imane, Irène, Julien, Joan, Laurence, Mathieu, Mickaël, Mireille Cousina, Mohammed, Nathalie, Qué
et Valérie.
Georges Barbier, Loïc Castrec, Marie-Anne Le Bras, Valérie Vasseur, Amélie Weill et Olivia Le
Bourhis de l’équipe du Lubem pour leur contribution à l’élaboration de ce travail.
Un grand merci à tous mes amis : Caroline, Georges, Hadrien, Jean-Claude, Lucie, Mai-Ahn, Marie,
Mathilde, Sunny, Teddy et The Thuong, pour tous les bons moments que l’on a passé ensemble. Ces
trois années passées à Reims n’auraient pas été les mêmes sans votre présence, votre sympathie et
votre bonne humeur.
Je remercie respectueusement mes parents, Catherine et Didier, pour leur soutien sans faille et leurs
encouragements, non seulement au cours de ces trois années mais aussi tout au long de mon parcours,
et sans lesquels je n’en serais pas là aujourd’hui. Vous m’avez donné toutes les chances pour réussir et
c’est grâce à vous que je suis ce que je suis maintenant. Je remercie sincèrement ma sœur Aurore pour
son aide précieuse et pour avoir toujours été à mes cotés durant ces années. Enfin, je remercie
Arnaud, mon mari, pour son soutien indéfectible, et pour avoir fait preuve de compréhension et
d’écoute malgré l’éloignement. Merci à Cannelle pour sa tendresse et son réconfort. Je ne pourrais
vous remercier assez...
Ces remerciements ne peuvent s’achever sans une pensée pour Alexandre Mazine.
Je dédie cette thèse à Claude Grimoult.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
1
/
196
100%