Exercices Physique-Chimie : Analyse de Systèmes (Terminale)
Telechargé par
chekib chekib

EPREUVE DE PHYSIQUE CHIMIE - Terminale!
Méthode d’analyse d’un système
1
MÉTHODES D’ANALYSE D’UN SYSTÈME
EXERCICES
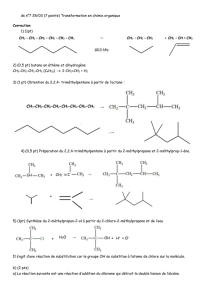
Ex1 : Une solution d’acide éthanoïque CH3COOH est titrée par une solution d’hydroxyde
de sodium de concentration molaire c = 10mmol.L-1.
Le suivi pH-métrique conduit à la représentation graphique ci-dessous :
!
L’équation de la réaction support de titrage s’écrit :
CH
3COOH(aq) + HO- (aq) → CH3COO- (aq) + H2O (l)
oExprimer puis calculer la quantité de matière ns,début de réactif titré.
Ex2 : Le titrage d’une solution d’acide nitrique (H3O+(aq),NO3-(aq)) par une solution
d’hydroxyde de sodium de concentration molaire c = 25 mmol/L est réalisé. L’équation de
la réaction de support de titrage s’écrit :
H
3O+(aq) + HO- (aq) → 2 H2O (l)
La courbe de suivi conductimétrique obtenue est :
!
Exprimer puis calculer la quantité de matière ns,début de réactif titré

EPREUVE DE PHYSIQUE CHIMIE - Terminale!
Méthode d’analyse d’un système
2
Ex3 : Le spectre infrarouge du pentan-2-ol est donné ci-dessous :"
!
"1- Comment s'interprète la présence des deux bandes d'absorption de gauche ? !
"2- La liaison C - O est-elle facilement détectable ?
Ex 4 : La formule brute d'un composé chimique est C5H10O.
Son spectre infrarouge est donné ci-dessous :
"
"

EPREUVE DE PHYSIQUE CHIMIE - Terminale!
Méthode d’analyse d’un système
3
"1- Quelles sont les liaisons possibles mises en évidence par le spectre ci-dessus ? !
"2- La molécule analysée peut-elle être l'une des 2 suivantes :
pentan-2-one : CH3 - CO - CH2 - CH2 - CH3
" "
pent-4-èn-1-ol : CH2 = CH - CH2 - CH2 - CH2OH
Ex 5 : Le jus d’un citron bien mûr contient environ 3g d’acide citrique, noté H3A.
Un échantillon (V = 10 mL) est prélevé d’une solution de volume V0 = 200 mL obtenue
avec le jus d‘un citron entier.
Il est titré par une solution d’hydroxyde de sodium de concentration en quantité
CB = 100 mmol/L. Les mesures de pH conduisent au nuage de points ci-contre.
!
Données :
•Masse molaire de l’acide citrique : M = 192 g.mol-1
•Table de données IR
a. Identifier les bandes en IR permettant de
caractériser l’acide citrique
b. Déterminer le volume Vb,eq de solution
titrante ajoutée à l’équivalence.
c. Exprimer puis calculer la quantité de matière
H3A dans l’échantillon titré.
d. En déduire la masse d’acide citrique présente
dans le citron. Conclure
1
/
3
100%