PHYSIQUE - THEME 1 chapitre 3
1
PHYSIQUE - THEME 1- chapitre 3 F.FRENO 9VG
THEME 1 : LA MATIERE
CHAPITRE 3 : les changements d’état
Objectif du CHAPITRE 3 :
Connaître le nom des changements d’état.
Savoir que la température est constante pendant le changement d’état d’un corps pur.
Savoir que pendant un changement d’état, le volume change mais la masse reste constante
Savoir tracer et lire un graphique
Connaître la carte d’identité de l’eau
Savoir que la température de changement d’état dépend de la pression
Connaître la définition d’un corps pur
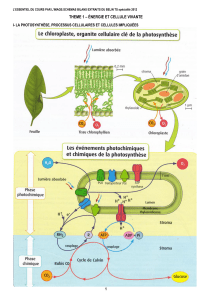
I. INTRODUCTION
Le passage d’un état d’agitation moléculaire faible à un état plus élevé (d'un état de la matière à un autre)
impose d’introduire de l’____________________ au sein des molécules (on parle de chaleur). Inversement,
le passage d’un état d’agitation élevé à un état plus faible ____________________- cette chaleur.
L'exemple classique : lorsque je désire faire bouillir de l'eau, pour cuisiner, je dois allumer la plaque
chauffante. En réalité, la plaque chauffante apporte de l'énergie (chaleur) à l'eau qui l'utilise d'abord pour
augmenter sa température et lorsque toute l'eau liquide est arrivée à une température de 100°C, l'eau passe
alors de l'état liquide à l'état gazeux (vapeur d'eau).
• Le passage de l’état solide à l’état liquide demande que l'on apporte de l'énergie à l'eau.
• Le passage de l’état liquide à l’état gazeux consomme également de l'énergie.
II. LE PASSAGE : SOLIDE LIQUIDE
Définition :
On appelle ___________________________________________le passage d’un état à un autre.
_____________________________ : C’est le passage de l’état liquide à l’état solide. De l’eau
placée au congélateur se solidifie. Huile quand il fait froid, lave arrivant dans l’océan…
_____________________________ : C’est le passage de l’état solide à l’état liquide. Des
glaçons fondent dans un verre. Beurre dans une poêle…

PHYSIQUE – THEME 1 – chapitre 3
2
PHYSIQUE - THEME 1- chapitre 3 F.FRENO 9VG
1. Solidification de l’eau pure
On étudie la température lors du refroidissement de l’eau pure.
Mesures : Refroidissement l’eau.
Étude du graphique :
La température est________________________ Elle diminue jusqu'à 0°C. L’eau est à
l’_____________________ ___________________________.
La température reste égale à 0°C. La glace commence à se former.
L’eau est à l’___________________ ______________________ + _________________________
La température est négative et diminue de nouveau. Toute l’eau s’est solidifiée.
L’eau est à l’____________________ _____________________________
-10
-5
0
5
10
15
20
0246810 12
T ( °C )
t ( min )
Etude de la température lors de la
solidification de l'eau pure
t (min)
0
1
2
3
4
5
6
7
8
9
10
11
T (°C)
20
10
5
1
0
0
0
0
0
-0.5
-1
-5
État de l’eau
L
L
L
L
L+S
L+S
L+S
L+S
L+S
S
S
S
1èr cristal de glace
Toute l’eau est solide
1ère goutte d’eau
Toute l’eau est liquide
Solidification
Solide
Liquide
Fusion

PHYSIQUE - THEME 1 chapitre 3
3
PHYSIQUE - THEME 1- chapitre 3 F.FRENO 9VG
Conclusion :
La solidification de l’eau pure s’effectue à _____________. °C. La température reste ______________________pendant la fusion.
Tsol (eau, °C) = 0 °C
2. Fusion de la glace pure.
Mesures : Réchauffement de la glace.
t (min)
0
1
2
3
4
5
6
7
8
9
10
11
T (°C)
- 6
- 4
- 2
- 1
0
0
0
0
0
1
4
10
État de l’eau
S
S
S
S
S+L
S+L
S+L
S+L
S+L
L
L
L
1ère goutte d’eau Toute l’eau est liquide
Étude du graphique :
Au départ de l'expérience, le bloc de glace a une température plus basse que sa température de
fusion. Toute l'énergie, la chaleur apportée va servir à augmenter la température du bloc de glace.
La température est ___________________ Elle augmente jusqu'à 0°C.
L’eau est à l’________________ ___________________________
-8
-6
-4
-2
0
2
4
6
0246810 12
T (°C)
t (min)
Etude de la température en fonction du temps.

PHYSIQUE – THEME 1 – chapitre 3
4
PHYSIQUE - THEME 1- chapitre 3 F.FRENO 9VG
Lorsque le bloc de glace est arrivé à la température de fusion de la glace (0°C), toute l'énergie va
maintenant servir à faire passer l'eau de l'état solide à l'état liquide (la glace rentre en fusion). Il n'y a pas
d'augmentation de température car toute l'énergie apportée est utilisée pour réaliser le changement
d'état. Durant cette phase, de l'eau sous forme solide et sous forme liquide vont être présentes dans le
milieu.
La température reste égale à 0°C. La glace commence à _____________________ :
État ___________________+ _____________________
Lorsque toute l'eau est passée sous forme liquide, la chaleur apportée va être utilisée afin
d'augmenter la température du liquide
La température est positive et augmente de nouveau. Toute la glace a fondu.
L’eau est à l’_________________________
Conclusion :
La fusion de la glace s’effectue à 0°C. La température reste ________________________pendant la fusion.
Tfus (glace, °C) = 0 °C
3. Masse et volume
Le volume varie-t-il lors d’un changement d’état ? ………………………..
Application : C’est pour cette raison qu’une bouteille pleine d’eau, mise au congélateur, se casse.
C’est aussi l’origine de l’expression populaire « un froid à fendre les pierres. » Les pierres contenant des
microfissures, l’eau peut s’y infiltrer. Lorsqu’il fait suffisamment froid (maximum 0°C) l’eau gèle dans les
microfissures et casse la pierre car le volume de la glace est plus important que celui de l’eau.

PHYSIQUE - THEME 1 chapitre 3
5
PHYSIQUE - THEME 1- chapitre 3 F.FRENO 9VG
La masse varie-t-elle lors d’un changement d’état ? ………………………..
4. Étude d’un autre corps que l’eau : le cyclohexane
Voici la courbe de solidification d’un corps pur autre que l’eau : le cyclohexane
1. Comment évolue la température au cours du temps ? ___________________________________
2. Sur la courbe, distinguer les trois phases étudiées.
3. A quelle température la solidification se produit-elle ? __________________________________
Conclusion :
La température de changement d’état d’un corps pur est constante et caractérise ce corps
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%