Spectrophotométrie: Protocole de labo cinétique réactionnelle
Telechargé par
Génie.procédés MGR

Université Kasdi Merbah Ouargla
Faculté des Sciences Appliquées
Département de Génie des Procédés
_________________________________________________________________________________
Année universitaire : 2019 / 2020
Niveau : 2éme LMD GP et RP
Module : TP Cinétique Chimique Enseignante : Dr. GHIABA ZINEB
2éme LMD GP et RP 1 TP Cinétique Chimique/ 2019-2020
TP N°3 Spectrophotométrie : SUIVI TEMPOREL D’UNE REACTION PAR SPECTROPHOTOMETRIE
Suivi cinétique de la réaction d’oxydoréduction entre l’eau oxygénée et les ions iodure
• La réaction entre le peroxyde d’hydrogène (eau oxygénée) H2O2 et les ions iodure I− est une réaction
lente.
• On souhaite : – effectuer un suivi temporel de la réaction – déterminer le temps de demi-réaction –
étudier l’influence d’un facteur cinétique
Matériel :
Spectrophotomètre, solutions de diiode 1,0 mmol / L, solution d’iodure de potassium 0,20 mol / L et
0,10 mol / L, solution d’eau oxygénée 2,0 x 10–3 mol / L, acide sulfurique 1,0 mol / L, deux burettes
graduées, pipette jaugée de 10 mL, seringue, fioles jaugées de 100 mL, chronomètres (2), 10 béchers,
pipette jaugée de 10 mL,
Fioles jaugées de 25 mL, cuves pour spectrophotomètre (20), pipette graduée de 2 mL et fiole jaugée de
500 mL.
Préparation de 500 mL de la solution acidifiée d’eau oxygénée de concentration
C2 = 2,0 x 10–3 mol / L : 1,1 mL d’eau oxygénée à 10 V,
10 mL d’acide sulfurique à 1 mol / L et on complète avec de l’eau distillée.
I- Le spectrophotomètre
1)- Mesure de l’absorbance d’une solution par spectrophotométrie.
a)- Principe.
On utilise le fait que toute solution colorée absorbe la lumière visible (400 nm < λ 0 < 800 nm).
Lorsqu’un faisceau de lumière monochromatique traverse un milieu absorbant,
l’intensité lumineuse I du faisceau transmis est inférieure à l’intensité lumineuse I 0 du faisceau incident.
Pour évaluer cette diminution, on utilise :
- La transmittance T :
- L’absorbance A :

2éme LMD GP et RP 2 TP Cinétique Chimique/ 2019-2020
- La transmittance s’exprime en pourcentage.
- À une transmittance T de 100 % (T = 1) correspond une absorbance nulle : A = 0.
- À une transmittance de 1 % (T = 0,01) correspond une absorbance A = log 100 = 2
- Exemple de réaction :
- On peut utiliser cette méthode lorsqu’une espèce colorée se forme ou disparaît au cours de la réaction.
- (Réaction entre l’eau oxygénée et les ions iodure : il se forme du diiode qui est une espèce chimique
colorée).
b)- Principe de fonctionnement.
- Un système dispersif (prisme ou réseau) permet de sélectionner une radiation lumineuse de longueur
d’onde donnée.
- Cette radiation est dirigée vers l’échantillon à analyser.
- Le flux lumineux transmis est mesuré et converti en valeur d’absorbance.
II- Relation entre l’absorbance et la concentration.
1)- Absorbance en fonction de la longueur d’onde.
- L’absorbance d’une solution colorée dépend de la longueur d’onde de la radiation lumineuse utilisée.
- On donne l’absorbance d’une solution de diiode en fonction de la longueur d’onde :
- Pour une solution de diiode de concentration C = 1,0 mmol / L, on mesure l’absorbance A pour
différentes longueurs d’ondes.
- La plage de variation de la longueur d’onde se situe dans l’intervalle suivant :
- 400 nm < λ < 700 nm.
- On règle la longueur d’onde sur la valeur souhaitée, on fait le blanc avec la solution étalon, puis on
mesure l’absorbance.
- Il faut répéter le mode opératoire pour chaque mesure.

2éme LMD GP et RP 3 TP Cinétique Chimique/ 2019-2020
- Courbe obtenue :
2)- Absorbance en fonction de la concentration.
a)- Manipulation.
Réglage du spectrophotomètre :
- On règle la longueur d’onde λ = 450 nm. On fait le blanc avec la solution étalon (solution d’iodure de
potassium).
Préparation de la solution : chaque groupe prépare la solution S de concentration C en diiode.
- On dispose d’une solution S0 de concentration en diiode C0 = 1,0 mmol / L.
- À partir de S0, préparer les solutions 10 mL de solution S en utilisant les solutions présentes dans les
burettes.
- Préparer la solution S et réaliser la mesure de l’absorbance de la solution préparée.
1
2
3
4
5
6
7
8
9
10
Solution S
mmol / L
0,10
0,20
0,30
0,40
0,50
0,60
0,70
0,80
0,90
1
Absorbance
A g1
0.120
0.256
0.435
0.578
0.723
0.818
0.997
1.149
1.281
1.404

2éme LMD GP et RP 4 TP Cinétique Chimique/ 2019-2020
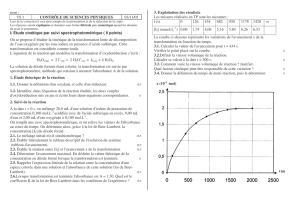
b)- Exploitation des mesures.
Décrire la méthode utilisée pour préparer S. Pourquoi a-t-on utilisé λ = 450 nm ?
- Recopier et compléter le tableau ci-dessus. Tracer la courbe A = f (C) ou [A = f (C[I2]] .
- La loi de Beer-Lambert : (A (λ) = ε (λ) . ℓ . C) est-elle vérifiée dans le domaine de concentrations
utilisées ?
- En déduire le coefficient d’absorption molaire ε (λ) du diiode en solution aqueuse (ℓ = 1,0 cm).
III- Suivi temporel de la réaction.
1)- Réaction entre l’eau oxygénée et l’iodure de potassium en milieu acide.
- Écrire Équation de la réaction :
H2O2 (aq) + 2 ……… + 2 I – (aq) → 2 ………….. + I2 (aq)
- Le diiode, qui donne à la solution une teinte jaune-orangé, est la substance absorbante.
- Les ions hydrogènes H+ (aq) sont-ils des catalyseurs de cette réaction ? Justifier.
2)- Expérience.
Dans un bécher, on verse : 100 mL d’iodure de potassium de concentration C1 = 0,20 mol / L, 10 mL
d’acide sulfurique de concentration C = 1,0 mol / L .
- À l’instant t = 0 (il faut faire démarrer le chronomètre), on ajoute 100 mL d’eau oxygénée de
concentration C2 = 2,0 x 10 –3 mol / L.
- On prélève 2 mL du mélange réactionnel à l’aide d’une seringue, on les verse dans la cuve pour le
spectre.
3)- Les mesures.
- On mesure la valeur de l’absorbance à différentes dates.
- Calculer la concentration [ I2 ] pour chaque date relevée.
- Reproduire et compléter le tableau suivant
t min
1
2
4
6
8
10
12
14
16
18
A
0,136
0.272
0.505
0.696
0.846
0.961
1.056
1.126
1.181
1.222
[I2] mmol / L
t min
20
24
28
32
36
40
44
48
52
A
1.256
1.305
1.339
1.357
1.367
1.373
1.376
1.376
1.376
[I2] mmol / L

2éme LMD GP et RP 5 TP Cinétique Chimique/ 2019-2020
4)- Exploitation des mesures.
4)- Exploitation des mesures.
- Dresser le tableau d’avancement de la réaction.
- Porter sur un graphique la concentration [ I2 ] en fonction du temps.
- Commenter l’aspect de la courbe.
- Quel(s) facteur(s) cinétique(s) est (sont) mis en évidence ?
- Déterminer l’expression de la vitesse volumique de la réaction en fonction de puis en
fonction de .
- Au préalable, on exprimera l’avancement de la réaction en fonction de [ I2 ] et V (volume du mélange
réactionnel, puis on exprimera [ I2 ] en fonction de A.
- Expliquer comment on peut déterminer la vitesse volumique de la réaction à partir de la courbe [ I2 ] = f
(t).
- Déterminer le temps de demi-réaction t1/2.
- Déterminer la vitesse volumique de réaction à t = 0 et à t = t1/2.
1
/
5
100%