Progression Annuelle Sciences Physiques 6ème, 5ème, 4ème
Telechargé par
Hamza Abarchi Halarou

1
REPUBLIQUE DU NIGER ANNEE SCOLAIRE : 2018 – 2019
REGION DE MARADI
DDES MADAROUNFA ET IES/ FA /MARADI
CELLULE PZDAGOGIQUE : SCIENCES PHYSIQUES
PROGRESSION ANNUELLE : 6ème
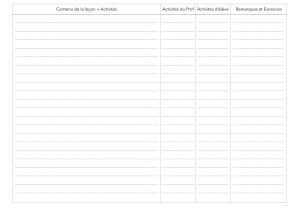
Semaines
Physique
Horaires
Chimie
Horaires
1
THEME 1 : PROPRIETES PHYSIQUES DE LA
MATIERE
Chapitre 1 : Formes et volumes
Leçon 1 : Les solides
1. Propriétés physiques
2. Mesures pratiques de volumes des solides (cube,
parallélépipède rectangle, cylindre)
1H
2
Leçon 2 : les liquides
1. Propriétés physiques
2. Mesures pratiques de volumes des liquides
1H
3
Leçon 3 : Propriétés physiques des gaz( l’air)
1H
4
Chapitre 2 : Etats de la matière
Leçon 1 : Etats de la matière
1. Différents états de la matière
2. Changement d’état de l’eau
1H
5
Leçon 2 : Tableau des changements d’état de l’eau
1H
6
Evaluation sommative
1H
7
THEME 1 : COMBUSTIONS
Chapitre 1 : les combustions
Leçon 1 : combustion des solides (bougie,
charbon de bois)
1. Expériences
2. Observations
3. Interprétation
1H
8
Leçon 2 : Combustion des liquides (pétrole)
1. Expérience
2. Observations
3. Interprétation
1H
9
Leçon 3 : Combustion des gaz (butane)
1H

2
1. Expérience
2. Observations
3. Interprétation
10
Chapitre 2 : Applications, dangers et
prévention
1. Applications
2. Dangers
3. Prévention
1H
11
Evaluation sommative
1H
12
Chapitre 3 : Masse d’un corps
Leçon 1 : Notion de masse
1. Définition
2. Appareil de mesure de la masse
3. Unité SI de mesure de la masse et ses sous – multiples
1H
13
Leçon 2 : Utilisation d’une balance
1. La simple pesée des corps solides et liquides
2. Différents types de balance
1H
14
THEME 2 : TEMPERATURE ET CHALEUR
Leçon 1 : Notion de température
1. Le thermomètre à liquide
a. Définition du thermomètre
b. Description d’un thermomètre
c. Schéma d’un thermomètre
2. Echelle Celsius et utilisation d’un thermomètre
1H
15
Leçon 2 : Notion de chaleur
1. Corps chauds et corps froids
2. Distinction entre température et chaleur
1H
16
Evaluation sommative
1H
17
THEME 2: COMPOSITION DE L’AIR
1. Principaux constituants de l’air
2. Proportion en volume des Principaux
constituants de l’air
3. Application
1H
18
THEME 3 : ELECTRICITE
Chapitre 1 : Lampe électrique
Leçon 1 : Circuit électrique et courant électrique
1H

3
1. Fonctionnement d’une lampe électrique à partir d’une
pile
a. Tension d’usage
b. Unité de la tension
2. Rôle de l’interrupteur
19
Leçon 2 : Conducteurs et isolants
1. Conducteurs
2. isolants
1H
20
Evaluation
21
Chapitre 2 : Montage des piles électriques en série
Leçon 1 : Réalisation et schéma d’un montage en série avec
deux piles électriques avec respect de tension d’usage
1H
22
Leçon 2 Réalisation et schéma d’un montage en série avec
trois piles électriques avec respect de tension d’usage
1H
23
Evaluation sommative
1H
REPUBLIQUE DU NIGER ANNEE SCOLAIRE : 2018 – 2019

4
REGION DE MARADI
DDES MADAROUNFA ET IES/ FA /MARADI
CELLULE PZDAGOGIQUE : SCIENCES PHYSIQUES
PROGRESSION ANNUELLE : 5ème
Semaines
Physique
Horaires
Chimie
Horaires
1
THEME 1: PROPRIETES PHYSIQUES DE LA
MATIERE
Chapitre 1 : méthodes de séparation physique des
constituants d’un mélange
Leçon1 : décantation et filtration
1. Décantation
2. Filtration
3. Mélange homogène – mélange hétérogène
1H
2
Leçon 2 : Distillation
1. Schéma
2. Définition
3. Propriétés physiques de l’eau pure
1H
3
Chapitre 2 : Masse volumique – Densité
Leçon 1 : Masse volumique d’un solide
1. Expérience
2. Définition
3. Expression et unité
4. Applications
1H
4
Leçon 2 : Masse volumique d’un liquide (eau)
1. Expérience
2. Définition
3. Expression et unité
1H
5
Evaluation sommative
1H
6
Leçon 3 : Masse volumique d’un gaz (l’air)
1. Expérience
2. Définition
3. Expression et unité
4. Applications
1H
7
Leçon 4 : Densité d’un solide par rapport à l’eau
1. Définition
1H

5
2. Expression
3. Calcul de la densité
8
Leçon 5 : Densité d’un liquide par rapport à l’eau
1. Définition
2. Expression
3. Calcul de la densité
1H
9
Leçon 5 : Densité d’un gaz par rapport à l’air
1. Définition
2. Expression
3. Calcul de la densité
1H
10
Exercices
1H
11
THEME : LES REACTIONS
CHIMIQUES
Leçon 1 : Combustion du magnésium
1. Expérience
2. Observations
3. Interprétation
1H
12
Leçon 2 : combustion du fer
1. Expérience
2. Observations
3. Interprétation
1H
13
Evaluation sommative
1H
14
Chapitre 3 : Dilatation
Leçon 1 : Dilatation des solides
1. Expérience
2. Définition de la dilatation
1H
15
Leçon 2 : Dilatation des liquides
1. Expérience
2. Définition de la dilatation
1H
16
Leçon 3 : Dilatation de l’air
1. Expérience
2. Définition de la dilatation
3. Comparaison de la dilatation des solides, des liquides
et gaz pour un ^même volume et à la même
température
1H
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
1
/
52
100%