
Classe de 5ème.
Cours. Thème 1
Organisation et transformations de la matière
Chapitre1.
Décrire les propriétés et les états de la matière.
I. DIVERSITÉ DES MATÉRIAUX. (Rappels de
6ème).
La matière qui nous entoure est très diverse : elle constitue
les solides, les liquides et les gaz. On peut la classer en
di/érentes catégories : Métal (fer, aluminium…), matière
minérale (les roches), verre, matière céramique, matières
plastiques, matière organique (produite par les êtres vivants
ou fabriquée).
II. LES PROPRIÉTÉS PHYSIQUES
Une propriété physique est une propriété que nous
pouvons observer à l’œil nu ou à l’aide de mesures sans
modifier la nature de la substance. Cela peut être la
température d’ébullition, la température de fusion, la
densité, la pression, la conductivité, la solubilité. Certaines
propriétés physiques peuvent être perçues par nos sens : la
couleur, la texture, la dureté, l’élasticité …
Les propriétés physiques peuvent être mesurées par des
appareils : thermomètre, balance, etc.
III. LES PROPRIÉTÉS CHIMIQUES
Les propriétés chimiques perme=ent d’identifier une
substance pure à l’aide d’une réaction chimique qui
changera la nature de la substance. Elles décrivent la
réaction d’une substance avec d’autres substances
chimiques.
Ex : la combustion : réaction d’une substance avec le
dioxygène.
IV. LES DIFFÉRENTS ÉTATS PHYSIQUES DE LA
MATIÈRE
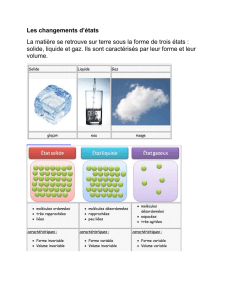
La matière peut exister sous trois états physiques :
solide, liquide, gaz.
Par exemple, l’eau existe sous les 3 états physiques : glace,
eau liquide, vapeur d’eau.
Chaque état physique dépend de 2 paramètres : la
température et la pression.
!
" #$%
& '%
( %
%
))%
$
*
)
+)
,$)
" ,$))
& - !
(
vocabulaire

SOLIDE (la glace) LIQUIDE (eau
liquide)
GAZEUX (vapeur
d’eau)
Ils ont une forme qui
leur est propre.
On peut les prendre
avec les doigts
Ils n’ont pas de forme
propre.
Ils prennent la forme
du récipient qui les
contient.
On ne peut pas les
prendre avec les
doigts.
La surface d’un liquide
au repos est plane et
horizontale.
Un gaz n’a pas de
forme propre,
il occupe tout le
volume qu’on lui
offre (le gaz qui
s’échappe d’une
gazinière sent
rapidement dans toute
la cuisine)
Le volume d’un solide
est constant (dilatation
très faible
Le volume d’un liquide
est constant (dilatation
faible : thermomètre)
Le volume d’un gaz
est variable (il dépend
du volume qui lui est
offert)
Les particules d’un
solide sont très
proches les unes des
autres et immobiles.
Les particules sont
liées entres elles.
L’état solide est un
état compact et
ordonné.
Les particules d’un
liquide sont proches
les unes des autres et
agitées.
Les particules sont
faiblement liées et
peuvent glisser les
unes sur les autres :
écoulement des
liquides.
L’état liquide est
compact et
désordonné.
Les particules d’un
gaz sont éloignées les
unes des autres et
très agitées.
Elles se déplacent
dans tous les sens à
grande vitesse.
Les particules ne sont
pas liées. L’état
gazeux est dispersé et
très désordonné.
.
-)
/
0$
$
)
11
" ,
& +)
( *
)
/
))
2
"
vocabulaire

I. Les différents état de la matière
La matière peut exister sous trois états: l’état solide, l’état liquide et l’état
gazeux. Par exemple, la glace ou la craie sont à l’état solide. L’eau est à
l’état liquide mais on peut aussi citer l’huile. L’air est à l’état gazeux et la
vapeur d’eau est aussi l’état gazeux de l’eau. Attention ! La vapeur d’eau est
invisible. Quand on pense que le petit nuage au-dessus de la casserole
d’eau est de la vapeur d’eau, c’est faux. Ce n’est pas de la vapeur d’eau
mais de la buée. La buée est constituée de petites gouttelettes d’eau liquide
en suspension. De même pour les nuages, c’est soit de l’eau à l’état liquide,
soit de l’eau à l’état solide.
II. Propriétés
A. Forme propre
On dit un objet il a une forme propre quand l’objet ne change pas de forme
lorsqu’on change de récipient. Par exemple, l’état solide a une forme propre
car quand on met une craie dans une bécher puis dans un tube à essai, elle
ne prend pas la forme du récipient. Ce n'est pas le cas à l'état liquide et à
l'état gazeux depuis passer place un liquide dans un bécher puis qu'on le
transvase dans un tube à essai, on voit bien que le liquide épouse la forme
du bénéficiaire. Idem pour l’état gazeux qui va épouser la forme du récipient
dans lequel il se trouve.
B. Volume propre
On dit que le volume a un volume propre lorsqu’il garde son volume quand
on le change de récipient. On dira il n’a pas de volume propre lorsqu’il prend
tout l’espace que sur lui offre, tout l’espace disponible. L’état solide a un
volume propre car lorsqu’on change la craie de recevoir, elle ne va pas
prendre tout l’espace disponible. C’est la même chose pour l’état liquide. Il
ne prend qu’une petite partie et non tout l’espace disponible. Ce n’est pas le
cas pour l’état gazeux, qui prend tout l’espace disponible. Par exemple, le
gaz se répartit dans la totalité du bécher ou dans la totalité du tube à essai,
qui sont fermés pour éviter qu’il parte dans l’air.
C. Surface horizontale
C’est une propriété concernant la surface de l’eau ou la surface des liquides
en général. Cette surface est horizontale donc parallèle au sol. Il faut faire
bien attention à cela dans le schéma puisqu’on a l’habitude de faire
perpendiculaire aux parois alors qu’en fait, la surface des liquides est
toujours horizontale quelque soit l’inclinaison des récipients.
D. Entités microscopiques
La matière est constituée de petits grains de matière que l’on va appeler des
entités microscopiques.
- A l’état solide, ces entités microscopiques sont disposées de manière
ordonnée et peu agitées.
- A l’état liquide, les entités microscopiques sont dans un état désordonné et
l’agitation est supérieure à l’état solide.
- A l’état gazeux, on est aussi dans un état désordonné et l’agitation est
encore plus forte qu’à l’état liquide. L’agitation augmente lorsque l’on passe
de l’état solide à l’état liquide et ensuite à l’état gazeux.
1
/
3
100%







![AnatomieN2 [Mode de compatibilité]](http://s1.studylibfr.com/store/data/003987537_1-29a7803a4edcfeaec312d59e6b5ba79f-300x300.png)
