GROUPE SCOLAIRE EDOUKOU MIEZAN Gd-BASSAM - GROUPE SCOLAIRE EDOUKOU MIEZAN Gd-BASSAM - GROUPE SCOLAIRE EDOUKOU
MIEZAN Gd-BASSAM
S C I E N C E S P H Y S I Q U E S
S É R I E: D
Cette épreuve comporte trois (03) pages notée 1/3 , 2/3 , 3/3 et une feuille annexe à rendre avec la copie.
PHYSIQUE 1 : 5 points
Les parties sont indépendantes.
On comprime à l’aide d’un solide (S) de masse m
s, un ressort de raideur k d’une longueur x
0 = 5 cm et à l’instant t = 0,
on le libère sans vitesse initiale. Le solide (S) percute
une bille (B) de masse m
b placée en B.
Les forces de frottement sont supposées négligeables
sur toutes les parties sauf sur BC (figure ci-dessous).
On donne: m
s = 30 g ; m
b = 10 g ; k = 300 N.m− 1
;
g = 10 m.s− 2
1.
Première partie : mouvement sur ABC
1.1 Calculer l’énergie mécanique E
0 du solide
à l’instant t = 0.
1.2 En utilisant la loi de la conservation de l’énergie mécanique, calculer la vitesse V
s du solide au point B juste
avant le choc.
1.3 Après le choc, la bille (B) aborde le plan horizontal BC de longueur L =50 cm, sur lequel s’exercent les
forces de frottement d’intensité constante f avec une vitesse V
b = 7,5 m.s− 1
. Elle arrive au point C avec une
vitesse pratiquement nulle.
Déterminer l’intensité f de la force de frottement.
2.
Deuxième partie : mouvement sur CD
La partie CD est un arc de cercle de centre O et de rayon r = 6 m. La bille est repérée par l’angle θ =
MOD.
On donne θ
0 =
COD = 60°
2.1 Vérifier que la vitesse de la bille au point M est : V2
M = 2gr(sinθ
0 – sinθ).
2.2 On montre par une loi physique que la réaction de la piste sur la bille est : R = m
E
r
bgsinθ - m V
b2
M
Donner l’expression de R en fonction de m, g, θ et θA
AE
0E.
2.3 Déterminer l’angle θA
AE
1Eau point E où la bille quitte le plan CD et vérifier que VA
AE
EE = 5,88 m.sA
− 1
AE
B A C C A L A U R E
A T
Coefficient
Durée
4
3heures
SESSION
Janvier 2013
1/4
(C) Wahab Diop 2013
Ce document a été télécharger sur http://physiquechimie.sharepoint.com

3.
Troisième partie : mouvement dans le champ
A
→
g
E
À l’instant t = 0, la bille quitte le point E avec la vitesse A
→
AEVA
EEE de norme VA
AE
EE = AE5,9 m.sA
− 1
AE
et faisant un angle θ
1 =
35,3° avec l’horizontale.
3.1 Dans le repère (E, →
i, →
j ), établir les équations horaires puis l’équation cartésienne du mouvement de la
bille. Faire l’application numérique pour l’équation cartésienne.
3.2 Déterminer les coordonnées du point d’impact I de la bille sur le sol sachant que E est à une hauteur h = 5
m du sol.
3.3 Calculer la vitesse de la bille lorsqu’elle arrive au point I.
PHYSIQUE 2 : 5 points
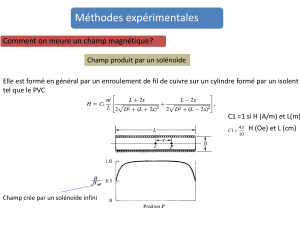
Un solénoïde de longueur L = 50 cm et comprenant 500 spires est parcouru par un courant continu d'intensité I.
1. Représenter sur la figure 1 de la feuille annexe, le vecteur champ magnétique à l’intérieur du solénoïde et
indiquer le nom de chacune des faces du solénoïde en justifiant ta réponse.
2. Sur la figure 2, dessiner et orienter une aiguille aimantée placée en chaque point P, R et S et représenter le
spectre magnétique en traçant les lignes de champ magnétique orientées à l’intérieur du solénoïde.
3. Quelle est la particularité du champ magnétique à l'intérieur du solénoïde ?
4. Quelle sera l'intensité du courant I
1 parcourant le solénoïde pour que la valeur du vecteur champ magnétique à
l’intérieure du solénoïde ait une valeur B
1 = 2,51 mT ?
5. On fait passer maintenant dans le solénoïde un courant d’intensité constante I
2 = 4 A.
Calculer la valeur B
2 du vecteur champ magnétique →
B
2 créé à l’intérieur du solénoïde.
6. Comparer B
1 et B
2. Que peut-on conclure ?
En déduire alors une relation entre le champ B créé à l’intérieur du solénoïde et l’intensité de courant I qui le
parcourt.
CHIMIE 1 : 5 points
Un professeur de SCIENCES PHYSIQUES de Lycée fait déterminer la concentration molaire d’une solution
d’hydroxyde de sodium par un groupe d’élèves. Pour cela, il remet au groupe d’élèves une bouteille contenant une
solution commerciale S
0 d’hydroxyde de sodium. Sur cette bouteille, on peut lire : densité = 1,2, contient 20,83% en
masse d’hydroxyde de sodium, masse molaire = 40 g/mol.
1. Vérifier que la concentration de la solution commerciale S
0 est C
0 ≈ 6,25 mol/L.
2. Afin de préparer une solution S
b d’hydroxyde de sodium, le groupe d’élèves prélève un volume V
0 = 2 mL de S
0
qu’il introduit dans une fiole jaugée de 500 mL puis il complète au trait de jauge avec de l’eau distillée.
Le groupe dispose de la verrerie suivante :
• Béchers : 50 mL, 100 mL, 250 mL ;
• Erlenmeyers : 125 mL, 250 mL, 500 mL ;
• Fiole jaugées : 100 mL, 250 mL, 500 mL, 1L ;
2/4
(C) Wahab Diop 2013
Ce document a été télécharger sur http://physiquechimie.sharepoint.com

• Pipettes : 1 mL, 2 mL, 5 mL, 10 mL ;
• Éprouvettes graduées : 10 mL, 25 mL, 50 mL.
2.1 Préciser la liste de matériels utilisée par le groupe pour préparer la solution S
b et donner le mode opératoire
complet de la dilution.
2.2 Calculer la concentration molaire C
b de la solution S ainsi préparée.
3. Afin de vérifier cette concentration C
b trouvée au 2.2°), le groupe procède à un dosage de la solution S
b par une
solution A d’acide nitrique de concentration C
a = 5.10− 2
mol/L. Il prélève alors un volume V
b = 20 mL de la
solution S
b qu’il met dans un bécher et à l’aide d’une burette graduée, le groupe verse progressivement la
solution A et mesure après chaque ajout, le pH du mélange. Les résultats sont consignés dans le tableau
suivant :
V
a
(mL) 0 2 3 4 5 5,5 6,5 7,5 8 8,5 9 9,5 10
pH
12,4 12,3 12,2 12,1 12,0 11,9 11,8 11,7 11,6 11,4 11,2 10,9 7
V
a
(mL) 10,5 11 11,5 12 12,5 14 15 18 20
pH
3,1 2,8 2,6 2,5 2,4 2,2 2,1 2,0 1,9
3.1 Faire le schéma expérimental permettant de réaliser le dosage.
3.2 Écrire l’équation bilan de la réaction.
3.3 Tracer sur une feuille de papier millimétré, le graphe pH = f(V
a) et déterminer les coordonnées du point
d’équivalence E. Échelle : 1 cm ↔ 1 mL et 1 cm ↔ 1 unité de pH
3.4 Définir l’équivalence acido-basique.
3.5 En déduire la concentration C
b de la solution S
b dosée. Comparer avec le résultat de 2.2°).
CHIMIE 2 : 5 points
1. La combustion complète dans le dioxygène, d’un échantillon d’un alcool saturé (A) ne contenant pas de cycle,
donne du dioxyde de carbone de masse m
1 et de la vapeur d’eau de masse m
2 telle que m
m
1
2
= 11
6.
1.1 Écrire l’équation bilan de la combustion en utilisant la formule générale brute de l’alcool.
1.2 En utilisant l’équation bilan précédente, montrer que
E
44n
E = A
mA
AEAE
2E
18n + 18
E avec n le nombre d’atomes de carbone
présents dans l’alcool. Calculer n.
m
1
1.3 Écrire les formules semi développées possibles des isomères de cet alcool.
2. On réalise l’oxydation ménagée d’un échantillon AA
AE
1E, isomère de A, en présence d’un excès de solution acidifiée
de bichromate de potassium. Le composé BA
AE
1E obtenu rougit le papier pH.
3/4
(C) Wahab Diop 2013
Ce document a été télécharger sur http://physiquechimie.sharepoint.com

L’oxydation ménagée d’un autre isomère A A
AE
2E de A en présence d’une solution acidifiée de bichromate de
potassium conduit à un composé BA
AE
2E qui réagit avec la DNPH mais est sans effet sur la liqueur de Fehling.
2.1 Préciser les fonctions chimiques de BA
AE
1E et BA
AE
2E ainsi que les classes des alcools AA
AE
1E et AA
AE
2E.
2.2 Trouver les formules semi développées des composés AA
AE
1E, AA
AE
2E, BA
AE
1E et BA
AE
2E .
3. On fait réagir l’éthanol avec le composé BA
AE
1E pour obtenir, au bout de quelques heures, un corps C.
L’action de la soude sur le corps C conduit à un corps D et de l’éthanol.
3.1 Déterminer les formules semi développées et les noms de C et D.
3.2 Nommer ces deux réactions et préciser leurs caractéristiques.
3.3 Écrire les équations bilans de ces réactions.
4. Le composé D peut aussi être obtenu à partir des réactions suivantes :
E + éthanol A
→ C + HCl (1)
F + éthanol → C + CH
3 - CH
2 – COOH (2)
4.1 Nommer les réactions (1) et (2). Préciser leurs caractéristiques
4.2 Identifier les composés E et F.
On donne en g/mol : M(H) = 1 ; M(C ) = 12 ; M(O) = 16
FEUILLE ANNEXE Á RENDRE AVEC LA COPIE
Figure 1
4/4
(C) Wahab Diop 2013
Ce document a été télécharger sur http://physiquechimie.sharepoint.com

Figure 2
5/4
(C) Wahab Diop 2013
Ce document a été télécharger sur http://physiquechimie.sharepoint.com
1
/
5
100%