Techniques modernes d'identification en microbiologie
Telechargé par
delphine.bretonniere

!
LES$TECHNIQUES$MODERNES$D’IDENTIFICATION$$
"#$%#&'!()*+,$-$%./0)!'1!#2'0-(3('!4-0'!#34.5)'6!4-0'!4#2*.'!37)*!5)'!83,.40-3(.$,'!#250.()'!
92(+$5)'! (#35.(.$,,)--)'! :! ;3')! 5)! -3! <$#83(.$,=! "3#<$.'! -)'! ')0-)'! 344-.*3;-)'! )(! ')#7),(! 5)! #2<2#),*)! $0! 5)!
*$,(#>-)!83.'!524),')!,$(3;-)!5)!()84'6!5)!8.-.)0?!)(!5)!83(2#.)-=!
14$Les$méthodes$standardisées$$
Intérêt$pratique$:$$
! !2*$,$8.)
!
! %3.,!5)!4-3*)
!
! 4$''.;.-.(2!5@30($83(.'3(.$,!!
Intérêt$scientifique$:$$
! 4#2*.'.$,
!
o ,$8;#)!5)!()'('!'042#.)0#'
!
o .5),(.<.*3(.$,!5)'!;.$(A4)'
!
o 0(.-.'3(.$,!53,'!-)'!),/0B()'!24.528.$-$%./0)'!!
! <.3;.-.(2!!
o *+$.?!C05.*.)0?!5)'!8.-.)0?!)(!5)'!5.7)#'!'0;'(#3('!!
o 4#243#3(.$,!'(3,53#5.'2)!)(!8.')!30!4$.,(!8.,0(.)0')!5)'!8$53-.(2'!()*+,./0)'!!
! !(#3.()8),(!,082#./0)!5)'!#2'0-(3('!37)*!$;(),(.$,!5@0,!*$5)!
!!
! (#3.()8),(!.,<$#83(./0)!5)'!#2'0-(3('!!!
Principe$des$méthodes$standardisées$(galeries$d’identification)$$
microméthodes$classiques
o !4#)8.&#)'!*$88)#*.3-.'2)'
o 4-0'!0(.-.'2)'
o )?4-$.(),(!-)'!#23*(.$,'!;.$*+.8./0)'!*$,'3*#2)'
o )?)84-)'!1!D,(2#$(0;)'6!E"F!GHD6!E"F!GHE6!E"F!I(34+!!
microméthodes$enzymatiques$$
o #23*(.$,'!$#.%.,3-)'!8.')!30!4$.,(!'42*.3-)8),(!!
o !8$53-.(2'!5)!-)*(0#)!(#&'!5.7)#'.<.2)'!J*$-$#3(.$,'!'4$,(3,2)'6!.,5.#)*()'6!<-0$#)'*),*)K!!

o !)?)84-)!1!E"F!I(#)46!E"F!LM9!!
!
microméthodes$auxanographiques$$
o 4$''.;.-.(2'!5@3''.8.-3(.$,!5)!5.<<2#),('!,0(#.8),('!J'0*#)'6!3*.5)'!38.,2'6!3*.5)'!$#%3,./0)'K!!
o -)*(0#)!5@0,)!*#$.''3,*)!4$'.(.7)!J(#$0;-)K!$0!,2%3(.7)!J-.84.5)K!N!)?)84-)!1!E"F!GH!OEPQ!!
!
!
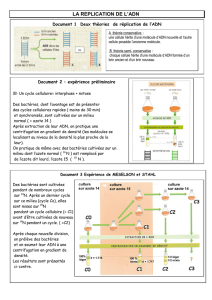
Galerie$d’identification$sur$milieux$en$tube$$
!"#$%&#'()#()*'%+'*,*-'(.+$$#/.*0&*'1'(2((
! 345(67',#$(
! !8,1/+,9:#(;+.<#((
!
IA'(&8)!E"F!GHD!
!

!
!
+((4'1RRSSS=A$0(0;)=*$8RS3(*+T7:/<'G;UA.MQPV.,5)?:WV-.'(:"X7*YZ4[F\#/C]Z^W3M#3_U`EHaFDb9(OE!
!+((4'1RRSSS=A$0(0;)=*$8RS3(*+T7:]S0c0d-[L-$V-.'(:"X7*YZ4[F\#/C]Z^W3M#3_U`EHaFDb9(OEV.,5)?:e!!
!
!!!

!
!
+((4'1RRSSS=A$0(0;)=*$8RS3(*+T7:%N+\LO"f<g$!

Règles$générales$d’emploi$$
=(!"0$#8($*./+'.+%*>9#(#,(,#','()?+/*#8,0,*+8(%/1&*$*80*/#'((
=($+)#(+%1/0,+*/#()+*,(.+//#'%+8)/#(@(&0($1,<+)#(.<+*'*#(A8+,*.#(,#.<8*>9#B((
=('9'%#8'*+8()+*,(C,/#(#--#.,91#()08'(&#($*&*#9(0%%/+%/*1(*8)*>91(%0/(&#(-0:/*.08,((
=('+9.<#'(%9/#'
=('9'%#8'*+8'(%0'(,/+%()#8'#'((
Limites$d’utilisation$$
=(,+9D+9/'(0%%&*>9#/(&0(/*E9#9/()#'(,#.<8*>9#'($*./+:*+&+E*>9#'()#(:0'#((
=(1,9)#()#(>9#&>9#'(-0$*&&#'($*./+:*#88#'((
24$Les$méthodes$automatisées$$
F+9,#'(&#'(1,9)#'()?08,*:*+E/0$$#('+8,(0.,9#&&#$#8,(09,+$0,*'0:&#'((
39,+$0,#'()?*)#8,*-*.0,*+8(5&'('#()*--1/#8.*#8,(%0/(2((
! )#E/1()?09,+$0,*'0,*+8(=()9/1#()?*8.9:0,*+8(
o (*8.9:0,*+8(.&0''*>9#(AGH(@(GI(<B(
o (*8.9:0,*+8('#$*=/0%*)#(AI(<B(
o (*8.9:0,*+8(#8(J(@(K(<((
! (E0$$#()#'(0%%&*.0,*+8'(%+''*:&#'(
! (8+$:/#()?080&7'#'(#--#.,91#'(
! )#E/1()?*8-+/$0,*'0,*+8()#'(/1'9&,0,'((
Exemples$:$$
!
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%