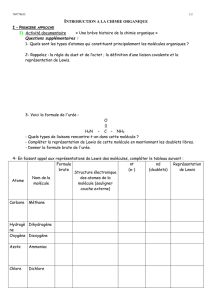
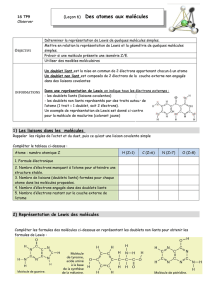
Cours de T. BRIERE - MOLECULES - Chapitre 2
1
L1 - CHIM 110 - “ATOMES ET MOLECULES”
Cours de Thierry BRIERE
DEUXIEME PARTIE : LES MOLECULES
Chapitre 2 : LA GEOMETRIE DES MOLECULES
Cette page (et tous les documents qui y sont attachés) est mise à
disposition sous un contrat Creative Commons.
Vous pouvez l’utiliser à des fins pédagogiques et NON
COMMERCIALES, sous certaines réserves dont la citation obligatoire
du nom de son auteur et l’adresse http://www2.univ-reunion/~briere
de son site d’origine pour que vos étudiants puissent y accéder.
Merci par avance de respecter ces consignes. Voir contrat…

Cours de T. BRIERE - MOLECULES - Chapitre 2
2
LA GEOMETRIE DES
MOLECULES

Cours de T. BRIERE - MOLECULES - Chapitre 2
3
!"
#"
#$%
##$
&'

Cours de T. BRIERE - MOLECULES - Chapitre 2
4
#(
)#
*+"&
#,(,,
##
&%
%
%

Cours de T. BRIERE - MOLECULES - Chapitre 2
5
-)
-)
.#
/($
-(
&(012
/(
3#
/($-*
&(014256
/(#
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%