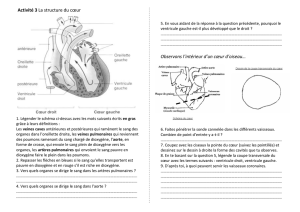
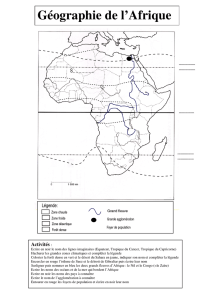
NOTION DE REACTION CHIMIQUE
I- Exemple de réaction chimique
1. Réaction fer et dioxygène
Le dioxygène et le fer sont appelé :……………………………….
L’oxyde de fer est appelé :
Le dioxygène ………………….. avec le ……………. pour donner …………
La réaction est schématisé par :
2. Réaction soufre et dioxygène
Les réactif de la réaction sont :…………………………..
Le produit de la réaction est :…………………………….
Le dioxygène ………………….. avec le ………….………. pour donner …………
La réaction est schématisé par :
3. Réaction carbone dioxygène
Activité
a. Légender la figure
b. Donner les réactifs de cette réaction
c. Quel est le gaz qui trouble l’eau de chaux ?
d. Quel est le produit de la réaction ?
e. Ecrire le schéma de la réaction
Chaîne recouverte de rouille : Chaîne oxydée

4. Réaction zinc et acide
Activité
a. Légender la figure
b. Donner les réactifs de cette réaction
c. Quel est le gaz qui donne une détonation en présence
de l’air et d’une flamme ?
d. Quel est le produit de la réaction ?
e. Ecrire le schéma de la réaction
II- Définition d’une réaction chimique
Exercice 1:
On laisse fondre à l’air libre un morceau de glace, après quelques minutes elle se transforme en
eau liquide.
Précise s’il s’agit ‘une réaction chimique ou d’une transformation physique.
Exercice 2:
Le fer et le soufre réagissent pour donner le sulfure de fer . Ce dernier a :
1. Préciser les réactifs et les produits de cette réaction.
2. Ecrire le schéma de cette réaction.
3. Barrer la proposition fausse .
Le sulfure de fer a :
a) les mêmes propriétés que le fer.
b) les mêmes propriétés que le soufre.
c) les mêmes propriétés que le mélange ( fer, soufre).
d) des propriétés différentes que celles du fer, du soufre et du mélange (fer, soufre).
Exercice 3:
Le dichlore réagit avec le sulfure d’hydrogène pour donner du soufre et du chlorure d’hydrogène.
1. Préciser les réactifs et les produits de cette réaction.
2. Ecrire le schéma de cette réaction.

III- Caractère qualitatif d’une réaction chimique
1. Réaction amorcée et réaction spontanée
1.1. Réaction amorcée
Activité
Le gaz de propane contenu dans un briquet réagit avec le dioxygène pour se
transformer en dioxyde de carbone et en vapeur d’eau.
a. Lorsqu appuie sur le bouton du briquet le ga de propane se mélange avec le
dioxygène de l’air. Pourquoi le mélange ne brûle pas ?
b. Quel est l rôle de l’étincelle ?
c. La réaction entre le propane et le dioxygène se produit-elle d’elle-même ?
d. Ecrire le schéma de la réaction.
e. Cette réaction est dite amorcée. Déduire une définition d’une réaction amorcée.
1.2. Réaction spontanée
Activité
Lorsqu’on introduit une lame de zinc dans une solution de sulfate de cuivre (de couleur bleu) ,
après quelques minute se forme du cuivre qui couvre la lame de zinc (dépôt rouge brique) et une
nouvelle solution.
a. S’agit-il d’une réaction chimique ? Pourquoi?
b. Y’a-t-il une intervention extérieur pour obtenir les produits ?
c. La réaction entre le zinc et le sulfate de cuivre est-elle amorcée ?
d. Cette réaction est dite spontanée. Déduire une définition d’une réaction spontanée.
2. Réaction lente et réaction rapide
2.1 Réaction lente
Activité
a. Ecrire le schéma de la réaction chimique de l’activité précédente.
b. La formation des produits est-elle instantanée ou lente ?
c. Déduire une définition d’une réaction lente.
2.2 Réaction rapide
Activité
Lorsqu’on ajoute la soude sur le sulfate de cuivre, il se forme de l’hydroxyde de cuivre solide et
nouvelle solution.
a. Ecrire le schéma de la réaction.
b. La formation des produits est-elle lente ou rapide.
c. Déduire une définition d’une réaction rapide.

3. Réaction exothermique et réaction endothermique
3.1 Réaction exothermique
Activité
Quand on verse une solution d’acide chlorhydrique sur de zinc
solide, il se dégage un gaz qui détone en présence d’une
flamme et se forme une nouvelle solution de chlorure de zinc.
a. Quels sont les produits de la réaction.
b. Ecrire le schéma de la réaction.
c. Comparer la température du mélange au début et à
la fin de la réaction.
d. La réaction dégage-t-elle de la chaleur ?
e. Déduire une définition d’une réaction exothermique.
Exercice : Préciser si la réaction de combustion du gaz de propane d’une cuisinière est
exothermique.
3.2 Réaction endothermique
Activité
Dans un tube à essais, versons une solution d’acide chlorhydrique, la température est 1
25C
q=°
.
Introduisons dans le tube à essais une petite quantité d’hydrogénocarbonate de sodium. Une vive
effervescence se produit. Il se dégage un gaz qui trouble l’eau de chaux. La température finale θ2
est inférieure à θ1 .
a. Donner les réactifs de cette réaction.
b. Quel est le gaz qui trouble l’eau de chaux et qui se dégage ?
c. Ecrire le schéma de la réaction.
d. La réaction dégage-t-elle de la chaleur ?
e. La baisse de la température prouve que la réaction absorbe de la chaleur. Déduire une
définition d’une réaction endothermique.
IV- Rôle d’un catalyseur
1
25C
q=°
2
70C
q=°
Au début de la
réaction A la fin de la
réaction
1
/
4
100%