Activité enzymatique et cinétique de la catalase
Introduction
La catalase catalyse la dismutation du peroxyde d’hydrogène en dioxygène et eau selon l’équation
bilan :
H2O2 + H2O2 ----- Catalase ------> 2 H2O + O2
Cette enzyme existe chez tous les organismes aérobies chez lesquels elle participe, comme la
peroxydase, à la défense contre les dérivés toxiques de l’oxygène. Elle agit pour des concentrations
plus élevées en peroxyde que la peroxydase.
La production de dioxygène au cours de la réaction permet suivre la réaction par oxygraphie (sonde
à oxygène interfacée avec un ordinateur).
La dismutation est une réaction d'oxydoréduction dans laquelle la même espèce chimique sert
d'oxydant et de réducteur.
La catalase existe chez tous les organismes aérobies chez lesquels elle participe, comme la
peroxydase, à la défense contre les dérivés toxiques de l’oxygène, mais elle agit pour des
concentrations plus élevées en peroxyde que la peroxydase. Elle se trouve en abondance dans les
navets, comme dans la plupart des organes souterrains des plantes, mais aussi dans le foie, la levure,
etc.
La catalase est peu sensible à la température : une variation de 10°C ne fait varier la vitesse de
réaction que de 10 %. Ce n'est donc pas critique d'avoir des variations de l'ordre de 1 à 2°C.
Il n'est pas nécessaire d'agiter compte tenu de l'activité extrêmement élevée de cette enzyme (6
millions de molécules de peroxyde décomposées par une seule molécule d'enzyme en une minute)
et du fait que l'agitation augmente la concentration en O2 dissous.
Pour les solutions de peroxyde, il est préférable d'utiliser de l'eau bouillie pour éliminer l'oxygène
dissous.
Le pH optimum de la catalase est de 6,8 à 7,5 selon l'espèce d'origine. Il y a inactivation à pH <5 ou
> 8.
Cette enzyme a aussi quelques particularités remarquables :
Tout d'abord, elle n'est pas saturable par son substrat car une concentration élevée en peroxyde
détruit la protéine catalase. Il n'est donc pas possible d'obtenir Vmax et de calculer un Km et il est
inutile de tester des concentrations supérieures à 50 mM : au delà, il y a inhibition de l'activité. Ceci
entraîne que pour obtenir une réaction du premier ordre, nécessaire pour le calcul de Vi, il faut
utiliser des concentrations en peroxyde inférieure à 50 mM.
L'eau oxygénée du commerce à 10 volumes (3 %) diluée au 1/250 correspond à une solution à 3,5
mmol/L. Les dilutions à utiliser doivent être choisies entre 1/50 et 1/1000.
Pour le calcul de Vi par la tangente, il faut faire les mesures à partir de 1 minute après l'injection de
l'enzyme.
Solutions et protocole

Peroxyde d’hydrogène à 10 volumes (3 %), extrait de navet (ou de foie, de levure, etc, ou solution
d’enzyme à 1 mg.mL-1).
Extrait de navet
Navet épluché et passé au mixer dans 150 mL de tampon saccharose-
phosphate pH 6,5.
Filtration du broyat sur filtre à café.
Filtrat collecté dans un erlenmeyer placé dans un cristallisoir contenant de la
glace.
Il est préférable de réaliser les dilutions de la solution de peroxyde d'hydrogène avec de
l’eau bouillie pour éviter l’introduction de dioxygène dans la solution. Pour la même
raison, éviter d’agiter les solutions et injecter l’enzyme lentement.
5 mL de solution de peroxyde sont placés dans la cuve pour déterminer la concentration
en dioxygène après étalonnage de l’électrode.
Au temps To, l’acquisition est déclenchée immédiatement après l’injection de 0,5 mL de
solution d’enzyme dans la cuve.
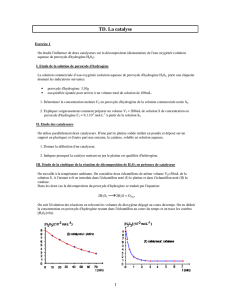
Production d'oxygène moléculaire par action de la catalase du
navet sur différentes concentrations de peroxyde d'hydrogène
(mesures réalisées avec une sonde à oxygène)

Vitesse initiale en fonction de la concentration en substrat (peroxyde d'hydrogène)
1
/
3
100%