726724858
POLE NUTRITION
4ème PARTIE : RESPIRATION
Chapitre 3 : Physiologie respiratoire
ACTIVITE 3 et 4
L’hémoglobine : structure et coopérativité
Activité 3 : Structure de l’hémoglobine
Lire les documents 1 et 2 et répondre aux
questions permettant de
comprendre la structure de
l’hémoglobine.
a) Encadrer sur le document 3 chacune des sous unités. Justifier l’appellation
hétéroprotéines.
b) Réaliser une schématisation d’une molécule d’hémoglobine. Mettre les 3 légendes
principales.
c) D’après les données des documents et
après visualisation de l’animation
http://www.ac-
creteil.fr/biotechnologies/doc_hemoglobin.ht
m, préciser le site exact de fixation de
l’oxygène à l’hémoglobine. Le dessiner sur le
document 3
d) Combien une hémoglobine peut-elle fixer
de dioxygène ?
e) Dessiner la fixation du CO2 sur le
document 3
Activité 4 : La fixation coopérative de l’O2
Après visualisation de l’animation
http://www.ac-
creteil.fr/biotechnologies/doc_hemoglobin.htm,
et lecture du document 4, répondre aux
questions suivantes :
a) Indiquez le nom de la molécule X.
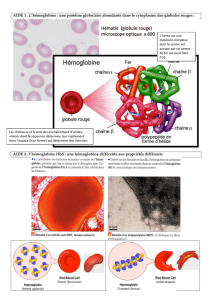
Document 1 :
Les molécules d’hémoglobines sont présentes dans le
cytoplasme des hématies.
Ce sont des hétéroprotéines, en effet, elles sont constituées
de 4 sous unités ou monomères, elles mêmes composées de 3
parties :
-Une partie protéique. Il existe 2 types de partie
protéique : la chaîne α et la chaîne β.
-Une partie non protéique constituée par l’hème.
-Au centre de l’hème un ion ferreux Fe2+.
Document 2 :
L’hémoglobine permet une fixation simultanée de
l’O2 et du CO2.
L’O2 se fixe au sein de l’hème.
Le CO2 se fixe sur les fonctions amines des
chaînes de protéines.
Document 3 :
Document 4 :
La formation de l’oxyhémoglobine est un
processus rapide : La fixation de la première
molécule d’O2 induit une modification de la forme
de la molécule d’hémoglobine (changement de
conformation) qui facilite la fixation de la 2ème. A
son tour cette fixation facilite la fixation de la
3ème et de même pour la 4ème. Il y a donc une
coopération des molécules d’O2 pour leur fixation.
Plus il y a d’O2 et plus la molécule d’hémoglobine a
de l’affinité (aime bien) pour l’O2.
Source: BPH – TST2S – Ed Nathan

726724858
b) Indiquez la formule des molécules d’hémoglobine A, B, C, D et E.
c) Situez la molécule d’oxyhémoglobine.
d) Indiquez à quoi correspondent les réactions R1 et R2.
e) Indiquez où ont lieu les réactions R1e t R2 dans l’organisme.
A
B
C
D
E
R1
X
R2
Source : BPH – TST2S – Ed Foucher
1
/
2
100%