Fécondation : Notes de Cours sur la Reproduction Humaine
Telechargé par
Noemie Abdallah

Fécondation
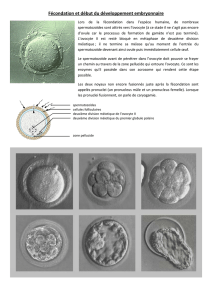
La fécondation représente la fusion de 2 gamètes haploïdes, ce qui aboutit à la formation d’une
cellule diploïde totipotente appelée zygote, ou œuf fécondé. Une cellule totipotente est une cellule
capable d’exprimer tout le programme génétique qu’elle contient.
Des étapes préliminaires sont nécessaires à la préparation de la fécondation. Ainsi, les
spermatozoïdes doivent transiter dans les voies génitales femme et subit des transformations qui
les rendent aptes à reconnaitre et traverser la zone pellucide.

• Transit des spz dans les voies génitales femme
En traversant l’épididyme, les spermatozoïdes ont acquis la mobilité, mais ont perdu leur
pouvoir fécondant lors de la décapacitation.
Au cours du transit dans les voies génitales femme, les spermatozoïdes sont re-capacités et
donc rendu capables de féconder l’ovocyte. Au cours de leur ascension vers les trompes, les
spermatozoïdes rencontrent un certain nombre de barrière biologiques, les unes facilitant, les
autres entravant leur progression, ce qui permet de réguler le nombre de spermatozoïdes présents
dans la trompe utérine. Sur 60M de spermatozoïdes déposés dans le vagin, 100 à 200 seulement
seront présent dans le lieu de fécondation.
• Le franchissement du canal cervical
Durant leur transit, de nombreux spermatozoïdes sont retenus dans les cryptes glandulaires.
Trois facteurs sont impliqués pour le passage :
• La mobilité des spermatozoïdes
• La structure et la composition du mucus ou glaire cervical
• Activité musculaire du vagin et de l’utérus
Le mucus cervical est la première barrière biologique régulatrice que rencontrent les
spermatozoïdes. Au moment de l’ovulation, le mucus cervical est abondant et fluide, ce qui favorise
le passage de quelques millions de spermatozoïdes dans le canal cervical.
Les spermatozoïdes non-sélectionnés par le mucus cervical sont détruits par le pH acide du
vagin.
• Traversée de la cavité utérine et des trompes
Au moment de l’ovulation, le péristaltisme (ou contraction rapide de la tunique musculaire
de l’utérus) assure le transport rapide des spermatozoïdes vers l’isthme tubaire, du côté du follicule
dominant. Le péristaltisme utérin est sous le contrôle de l’œstradiol sécrété par le follicule
dominant et aussi sous le contrôle de l’ocytocine.
Jonction utéro-tubaire
Trompe

Cavité génitale
Canal cervical
Cavité utérine
Isthme
Frange tubulaire
Ampoule
De quelques millions on passe a quelques milliers qui iront jusqu’aux trompes. En effet, les
glandes utérines forment la seconde barrière sélective à leur ascension des spermatozoïdes. Un
grand nombre de spermatozoïdes restent captifs dans les glandes utérines, ils constituent une
réserve de spermatozoïdes ce qui permet d’entretenir un flux constant de spermatozoïdes au
niveau des trompes. Dans les trompes, les spermatozoïdes rencontrent deux nouvelles barrières : la
jonction utero-tubaire et les jonctions isthmiques.
Grâce à leurs flagelles, les spermatozoïdes remontent le courant qui entraine le liquide
tubaire vers l’utérus qui est entretenu par les battements des cils de l’épithélium tubaire et des
contractions musculaires. Seulement quelques centaines de spermatozoïdes parviennent au niveau
de l’ampoule (lieu fécond). A ce niveau, les spermatozoïdes entourent rapidement l’ovocyte.
• La capacitation des spermatozoïdes
Les spermatozoïdes émis lors de l’éjaculation ne sont pas capables de déclencher la réaction
acrosomique (donc de traverser la zone pellucide), donc ils sont incapables de franchis la
membrane plasmique de l’ovocyte, il ne peut donc pas avoir de fécondation.
L’aptitude à féconder l’ovocyte dépend de la capacité des spermatozoïdes à déclencher la
réaction acrosomique. Cette capacité est acquise lors du séjour des spermatozoïdes dans les voies
génitales femme. La traversé du tractus génital élimine le plasma génital de la surface des

spermatozoïdes. Les modifications qui se produisent pendant ce séjour sont désignées par le terme
« capacitation ».
Fécondation
Dans l’espère humaine, la capacitation dure environ 5h. Elle se manifeste par des
modifications important de la membrane plasmiques des spermatozoïdes ce qui entraine une
désorganisation de la double couche lipidique de la membrane plasmique, et donc une perte des
molécules de décapacitation incorporées lors de la maturation dans l’épididyme. La membrane
plasmique devient hyper polarisée par l’ouverture des canaux calciques voltage-dépendant, ce qui
provoque une augmentation de la concentration intracellulaire en Ca2+ et une augmentation du pH
intracellulaire.
Les modifications membranaires provoquent des changements au niveau de la mobilité des
spermatozoïdes, ce qui se traduit par l’augmentation de l’amplitude du battement flagellaire et la
modification de la trajectoire ; les spermatozoïdes sont alors dits « hypermobiles » ou « fléchants ».
Ils peuvent ainsi remonter les voies génitales femme et atteindre de lieu de fécondation.
• La fécondation
La rencontre des gamètes se produit dans le tiers externe de l’une des deux trompes. La
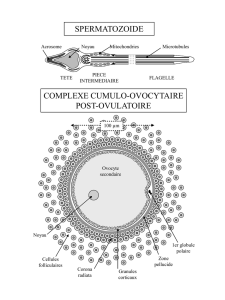
fécondation représente la fusion d’un spermatozoïde et d’un ovocyte II. L’ovocyte bloqué en
métaphase de seconde division de méiose est entouré par la zone pellucide et le cumulus oophorus.
Pour fusionner avec l’ovocyte, le spermatozoïde doit traverser le cumulus oophorus, la
corona radiata et reconnaitre la zone pellucide, s’y fixer, la traverser (il se retrouve dans l’espace
péri-vitellin) et enfin traverser la membrane plasmique de l’ovocyte.

• Traversée des cellules de la granulosa
Grâce à une hyaluronidase liée à la membrane plasmique des spermatozoïdes, les cellules de
la granulosa sont dissociées et traversées par quelques spermatozoïdes hypermobiles.
• La liaison à la zone pellucide
La zone pellucide (formée d’un réseau de 3 glycoprotéines sulfatées élaborées par l’ovocyte
et les cellules péri-ovocytaires de la corona radiata) facilite la migration tubaire de l’ovocyte en
évitant l’implantation dans les trompes. Elle sert aussi de barrière d’espèce, car elle interdit les
fécondations croisées et elle permet au sein d’une même espèce, la liaison d’un spermatozoïde via
ZP3.
En effet, la partie antérieure de la membrane plasmique des spermatozoïdes (qui recouvre
l’acrosome) contient des récepteurs à ZP3. La liaison ZP3-spermatozoïde est réversible. La
reconnaissance de ZP3 par le spermatozoïde déclenche la réaction acrosomique.
La progestérone sécrétée par les cellules de la corona radiata représente un important
cofacteur pour le déclenchement de la réaction acrosomique.
La réaction acrosomique se traduit par la fusion de la membrane plasmique du
spermatozoïde et de la membrane externe de l’acrosome en de multiples zones. Aux zones de
fusion, les membranes se résorbent. Les résidus des membranes sont éliminés sous forme de
vésicules membranaires. La résorption des membranes expose la membrane interne de l’acrosome
au contact de la zone pellucide.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%