République Algérienne Démocratique et Populaire
DEPARTEMENT DE PHARMACIE
THÈME :
Analyse physico-chimique et bactériologique et parasitologique de
l’eau de mer traitée par la station de dessalement de Souk
Tleta « Tlemcen »
Présenté par : Zouag Bilal , Belhadj Yassine
Soutenu le 21-06-2017
Le Jury
Président : Benyahia Djamila Maître assistante en Parasitologie
Membres : Adda Fatema Maître assistante en Hémobiologie
Elyebdri Nassima Maître assistante en Pharmacognosie
Encadreur : Benamara Salim Maître assistant en Hydro-bromatologie
Co-encadreur : Benhadouche Iméne Assistante en Hydro-bromatologie
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE ABOU BEKR BELKAÎD
FACULTE DE MEDECINE
DR. B. BENZERDJEB - TLEMCEN
MEMOIRE DE FIN D’ ETUDES POUR
L’OBTENTION DU DIPLOME DE DOCTEUR EN PHARMACIE

Remerciements
Avant tout, nous remercions ALLAH tout puissant, de
nous avoir accordé la force, le courage et les moyens
pour la réalisation de ce travail.
Nous tenons à remercier Mr. Benaamara Salim d'avoir
accepté de nous encadrer sur ce thème, de nous avoir
conseillé judicieusement, orienté, encouragé et de nous
apporter son attention tout au long de ce travail.
Mme.Benhadouche Iméne d'avoir accepté de Co-
encadrer ce
Travail et pour ses conseils judicieux.
Nous tenons également à remercier Mme,Benyahia
Djamila D’avoir accepté de présider le jury.
Nous remercions Mme.Adda Fatema et Mme Elyebdri
Nassima qui nous ont honoré pour examiner notre
travail.
Nos remerciements s’adressent aussi à :
L’ensemble du personnel de la station de dessalement de
l’eau de mer de Souk Tleta, du laboratoire central et du
laboratoire du bureau d’hygiène du CHU Tlemcen qui
nous ont facilité l’avancement de la partie analyse.

Dédicaces
Avec l’aide et la protection d'ALLAH
S’est réalisé ce travail.
Nous dédions ce travail à :
Nos trop chers parents qui nous ont toujours apportés
l’amour et l’affection
Toute les familles Zouag et Belhadj
Nos amis K. Ayoub, B. Hichem et D. Younes
Nos camarades de promo de Pharmacie
Et tous les amis

i. Table des Matières
II. LISTE DES ABREVIATIONS
III. LISTE DES TABLEAUX
IV. LISTE DES FIGURES
INTRODUCTION GENERALE .................................................................................................................. 2
Partie I : Revue bibliographique
CHAPITRE 1 : GENERALITES SUR L’EAU ................................................................................................ 5
1-INTRODUCTION .................................................................................................................................. 5
2-DEFINITION DE L’EAU .......................................................................................................................... 5
3-IMPORTANCE DE L’EAU ........................................................................................................................ 6
4-CYCLE DE L’EAU ................................................................................................................................. 6
5-REPARTITION DE L’EAU SUR LA PLANETE ................................................................................................... 7
6-ADEQUATION ENTRE RESSOURCES ET BESOINS EN EAU ................................................................................. 9
7-SOURCES D’EAU ............................................................................................................................... 10
7.1-Eaux souterraines ................................................................................................................. 11
7.1.1-les nappes.............................................................................................................................................. 11
7.1.1.1-Définitions ..................................................................................................................................... 11
7.1.1.2-Les différents types de nappes..................................................................................................... 11
7.1.1.3- la plus grande nappe phréatique du monde .............................................................................. 12
7.2-Eau de surface ...................................................................................................................... 12
7.3-Eau saline ............................................................................................................................. 12
7.3.1-Eau de mer ............................................................................................................................................ 12
7.3.2-Eaux saumâtres ..................................................................................................................................... 13
7.3.3-Origine de la salinité ............................................................................................................................. 14
7.4-Principales différences entre eaux superficielles et eaux profondes ...................................... 15
8-EAU EN ALGERIE .............................................................................................................................. 16
9-QUALITE DE L’EAU ............................................................................................................................ 17
9.1-Paramètres physicochimiques : ............................................................................................ 17
9.2-Facteurs toxiques ................................................................................................................. 18
9.3-Facteurs microbiologiques .................................................................................................... 18
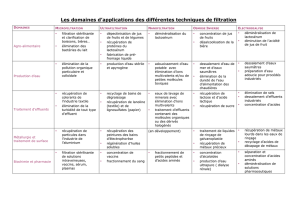
CHAPITRE 2 :POLLUTION DES EAUX ................................................................................................... 20
1-GENERALITES .................................................................................................................................. 20
2-DEFINITION .................................................................................................................................... 20
3-SOURCES DE LA POLLUTION................................................................................................................. 20
3.1- pollution domestique........................................................................................................... 20
3.2- pollution industrielle ............................................................................................................ 21
3.3- pollution agricole ................................................................................................................ 21
3.4- pollution accidentelle .......................................................................................................... 21
5- PRINCIPAUX POLLUANTS .................................................................................................................... 22
6-CONSEQUENCES DE LA POLLUTION ....................................................................................................... 22
7-PRINCIPALES MALADIES D’ORIGINES HYDRIQUES ...................................................................................... 23
CHAPITRE 3 : TRAITEMENT DE L’EAU ................................................................................................. 25
1-INTRODUCTION ................................................................................................................................ 25
2-HISTORIQUE DU TRAITEMENT DES EAUX ................................................................................................. 25
3-IMPORTANCE DU TRAITEMENT DES EAUX ................................................................................................ 26

4-TRAITEMENTS DE L’EAU ..................................................................................................................... 26
4.1-Traitement physico-chimique des eaux de boisson ............................................................... 26
4.1.1-Le prétraitement ................................................................................................................................... 26
4.1.1.1-Prétraitement physique................................................................................................................ 26
4.1.1.2-Prétraitement chimique : Pré oxydation ..................................................................................... 27
4.1.2-Traitement de clarification ................................................................................................................... 27
4.1.2.1-Décantation ................................................................................................................................... 27
4.1.2.2-Coagulation floculation ................................................................................................................ 27
4.1.2.3- filtration........................................................................................................................................ 28
4.3.3- affinage ................................................................................................................................................. 28
4.2- désinfection de l’eau ........................................................................................................... 28
4.2.1-Définition et intérêt de la désinfection ................................................................................................ 28
4.2.2- mécanisme de désinfection ................................................................................................................. 29
4.2.3- désinfection chimique ......................................................................................................................... 29
4.2.3.1- désinfection par le chlore ............................................................................................................ 29
4.2.3.2- désinfection par l’ozone .............................................................................................................. 30
4.2.4- désinfection physique : La désinfection par les rayons UV ................................................................ 31
CHAPITRE 4 : PROCEDES DE DESSALEMENT : ..................................................................................... 33
1-INTRODUCTION ................................................................................................................................ 33
2-DEFINITION .................................................................................................................................... 33
3-HISTORIQUE ................................................................................................................................... 34
4- DIVERS PROCEDES DE DESSALEMENT ..................................................................................................... 35
5-LES PROCEDES DE DISTILLATION ........................................................................................................... 35
5.1-Distillation a simple effet ...................................................................................................... 36
5.2-Distillatioon à multiples effets .............................................................................................. 36
5.3-Distillation par détentes successives ..................................................................................... 37
5.4-Distillation par Compression mécanique de vapeur .............................................................. 38
5.5- Comparaison entre les méthodes de distillation .................................................................. 39
6- LES PROCEDES MEMBRANAIRES ........................................................................................................... 39
6.1-L’ultrafiltration (UF) ............................................................................................................. 40
6.2-La microfiltration (MF) ......................................................................................................... 40
6.3-L’électrodialyse .................................................................................................................... 40
6.4- L’osmose inverse ................................................................................................................. 40
6.4.1-Définition ............................................................................................................................................... 40
6.4.2-Osmose inverse Procédé de choix ....................................................................................................... 41
6.5-Comparaison entre les méthodes membranaires .................................................................. 42
7-DESSALEMENT DE L’EAU DE MER : OSMOSE INVERSE OU DISTILLATION ? ........................................................ 42
8-PROBLEMES TECHNIQUES RENCONTRES EN DESSALEMENT .......................................................................... 44
8.1-La corrosion ......................................................................................................................... 44
8.2-L’entartrage ......................................................................................................................... 44
8.3-Le colmatage (Fouling) ......................................................................................................... 44
9-MARCHE ET ASPECT ECONOMIQUE DU DESSALEMENT DES EAUX .................................................................. 44
10-LE DESSALEMENT EN ALGÉRIE.................................................................................................... 47
10.1-Historique .......................................................................................................................... 47
10.2-Station de dessalement en Algérie ...................................................................................... 48
10.2.1-Petites stations : ................................................................................................................................. 48
11-CONCLUSION ................................................................................................................................. 51
Partie II : Partie pratique
CHAPITRE 1 : MATERIELS ET METHODES ............................................................................................ 53
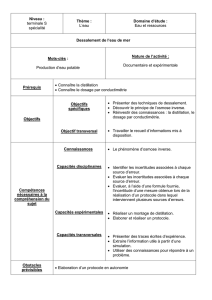
1- OBJECTIFS DE L’ETUDE ...................................................................................................................... 53
1.1- objectif principale ................................................................................................................ 53
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
1
/
155
100%