50-020-B-10
Barrière
épidermique
R.
Abdayem, M.
Haftek
La
peau
joue
le
rôle
d’interface
entre
l’organisme
et
son
milieu
environnant.
L’épiderme,
la
couche
la
plus
superficielle
de
la
peau,
assure
essentiellement
cette
fonction
de
protection
interactive.
La
barrière
épidermique
peut
être
sous-divisée
en
trois
systèmes
de
défense
:
la
barrière
photoprotectrice
;
la
barrière
immunitaire
;
la
barrière
physique
et
chimique
de
la
couche
cornée.
Afin
de
se
protéger
des
rayonnements
ultraviolets
nocifs,
l’épiderme
dispose
de
facteurs
d’absorption
tels
la
mélanine,
produite
par
les
méla-
nocytes,
et
l’acide
urocanique
–un
produit
de
dégradation
de
la
filaggrine.
Le
système
épidermique
de
défense
immunitaire
comprend
un
versant
inné,
rapide
mais
non
spécifique,
et
la
réponse
adaptative,
systémique
et
spécifique
d’antigène,
initiée
par
les
cellules
de
Langerhans.
Le
produit
de
la
différen-
ciation
terminale
des
kératinocytes
épidermiques,
le
stratum
corneum
assure
la
fonction
essentielle
de
barrière
physique
et
chimique
de
perméabilité.
Cette
couche
cornée
est
constituée
de
cornéocytes,
dotés
d’enveloppes
cornifiées
et
liés
entre
eux
par
des
cornéodesmosomes,
et
de
la
matrice
extracellulaire
lipi-
dique
organisée
en
feuillets.
La
barrière
épidermique,
en
constant
renouvellement,
se
caractérise
par
une
très
grande
capacité
d’adaptation
aux
conditions
changeantes
de
l’environnement.
©
2015
Elsevier
Masson
SAS.
Tous
droits
réservés.
Mots-clés
:
Barrière
;
Épiderme
;
Protection
;
Stratum
corneum
Plan
■Introduction
1
■Barrière
photoprotectrice
1
■Barrière
immunitaire
2
■Barrière
physique
et
chimique
de
la
couche
cornée
2
Cytosquelette
des
cornéocytes
3
Filaggrine
3
Enveloppes
cornifiées
3
Lipides
intercellulaires
3
Cornéodesmosomes
4
Peptides
antimicrobiens
4
■Barrière
des
jonctions
serrées
4
■Fonctionnement
de
la
barrière
épidermique
4
Introduction
L’épiderme
est
un
épithélium
pavimenteux
stratifié
et
kérati-
nisé
composé
majoritairement
par
les
kératinocytes.
Il
peut
être
divisé
en
quatre
couches
successives,
classées
suivant
l’état
de
dif-
férenciation
des
cellules
qui
les
constituent.
Le
stratum
basal
est
la
couche
la
plus
profonde
de
l’épiderme,
formée
d’une
assise
de
kératinocytes
au
pouvoir
germinatif,
dont
les
cellules
souches.
Les
cellules
filles,
engagées
dans
la
voie
de
différenciation
termi-
nale,
quittent
le
compartiment
basal
et
modifient
leur
expression
génique [1,
2].
Ainsi,
la
synthèse
de
nouvelles
protéines,
telles
les
kératines
1,
10
et
2,
l’involucrine,
la
loricrine
ou
la
profilaggrine,
est
engagée
progressivement
dans
les
couches
suivantes
:
le
stra-
tum
spinosum
puis
le
stratum
granulosum.
Le
produit
final
de
la
différenciation
des
kératinocytes,
le
stratum
corneum,
assure
la
fonction
de
barrière
de
perméabilité.
Constituant
l’interface
entre
l’organisme
et
l’environnement
externe,
le
stratum
cor-
neum
contrôle
les
échanges
hydriques
entre
ces
deux
milieux [3].
Cette
fonction
est
primordiale
pour
la
survie
de
l’organisme
dans
l’environnement
terrestre.
Aussi,
l’épiderme
limite
la
diffusion
de
beaucoup
d’agents
chimiques,
de
rayonnements
ultraviolets,
et
la
pénétration
des
agents
pathogènes.
Les
bactéries,
virus
et
champi-
gnons
ne
sont
pas
seulement
bloqués
physiquement
à
la
surface
de
la
peau,
mais
aussi
confrontés
à
un
panel
de
protéines
antimi-
crobiennes
sécrétées
par
les
cellules
cutanées [4].
Deux
populations
des
cellules
dendritiques
non
épithéliales,
les
mélanocytes
dans
le
stratum
basal
et
les
cellules
de
Langerhans
dans
le
stratum
spino-
sum,
constituent
respectivement
deux
barrières
supplémentaires
:
une
pigmentaire,
photoprotectrice,
et
l’autre
de
sentinelles
immu-
nocompétentes
(immunité
acquise)
(Fig.
1).
Barrière
photoprotectrice
Les
rayonnements
ultraviolets
(UV)
émis
par
le
soleil
sont
divi-
sés
en
trois
catégories
selon
leur
énergie.
Les
UVC
(270–290
nm),
les
plus
nocifs,
sont
arrêtés
par
la
couche
d’ozone
dans
la
stra-
tosphère.
Les
UVB
(290–315
nm)
sont
responsables
d’érythème
cutané
(coup
de
soleil)
et
induisent
des
mutations
mais
ne
pénètrent
pas
au-delà
de
l’épiderme.
Le
rayon
d’action
des
UVA
(315–400
nm)
atteint
le
derme
superficiel.
L’exposition
répétée
et
prolongée
aux
UVA
est
responsable
de
l’élastose
dermique
et
EMC
-
Cosmétologie
et
Dermatologie
esthétique 1
Volume
10
>
n◦1
>
octobre
2015
http://dx.doi.org/10.1016/S2211-0380(15)65708-8
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 09/06/2017 par UNIVERSITE PARIS VI - BIBLIOTHEQUE - (15258). Il est interdit et illégal de diffuser ce document.

50-020-B-10 Barrière
épidermique
Kc
CL
Mc
1
2
3
4
5
6
7
8
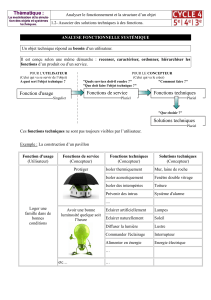
Figure
1.
La
barrière
épidermique.
Représentation
schématique
de
la
différenciation
des
kératinocytes
(Kc)
de
l’épiderme
et
la
formation
du
stra-
tum
corneum
(1).
Cette
couche
cornée
est
composée
par
l’empilement
de
cellules
mortes,
liées
entre
elles
par
des
jonctions
(cornéodesmosomes)
(3)
et
une
matrice
lipidique
intercellulaire
organisée
en
lamelles
(aux
propriétés
hydrophobes)
(2).
Les
lipides
sécrétés
à
l’interface
entre
les
couches
vivantes
et
le
stratum
corneum
s’ajoutent
aux
autres
éléments
matriciels
présents
entre
les
cellules
nucléées.
Grâce
à
sa
structure
et
composition,
la
couche
cornée
assure
une
barrière
physique
et
chimique,
limitant
le
passage
d’eau
et
protégeant
contre
la
pénétration
de
molécules
exogènes
et
de
pathogènes.
Deux
populations
des
cellules
dendritiques
non
épithéliales,
les
mélanocytes
(Mc)
et
les
cellules
de
Langerhans
(CL)
participent,
respectivement,
aux
deux
barrières
supplémentaires
au
sein
de
l’épiderme
:
photoprotectrice
et
immunitaire.
4.
Stratum
granu-
losum
;
5.
matrice
intercellulaire
;
6.
stratum
spinosum
;
7.
stratum
basale
;
8.
membrane
basale
de
la
jonction
dermoépidermique.
“
Point
fort
La
barrière
épidermique
comporte
la
barrière
physique
et
chimique
du
stratum
corneum
(limitant
la
perméabilité),
une
barrière
photoprotectrice
et
une
barrière
immunitaire.
du
vieillissement
cutané
photo-induit.
Même
si
l’exposition
aux
rayons
UV
est
indispensable
pour
la
synthèse
de
la
vitamine
D
dans
la
peau,
les
effets
nocifs
sont
nombreux
et
nécessitent
des
systèmes
endogènes
de
photoprotection
efficaces.
La
mélanine
est
un
pigment
synthétisé
par
les
mélanocytes
et
transféré
vers
les
kératinocytes,
qui
le
retiennent
dans
leur
cytoplasme
en
des-
sus
des
noyaux.
Le
nombre
très
élevé
de
liaisons
présentes
dans
ce
polymère
d’indole
et
dans
des
produits
intermédiaires
dérivés
de
l’oxydation
de
la
tyrosine
confère
à
la
mélanine
son
pouvoir
absorbant
des
rayonnements [5].
Dans
les
peaux
noires,
les
grains
de
mélanine
(mélanosomes)
persistent
jusqu’à
la
couche
cornée.
En
plus
de
la
fonction
photoprotectrice,
on
prête
aux
mélanocytes
beaucoup
d’autres
fonctions
régulatrices,
y
compris
l’influence
sur
la
qualité
de
barrière
du
stratum
corneum [6].
Par
ailleurs,
il
existe
d’autres
molécules
épidermiques
endogènes,
à
part
la
mélanine,
qui
assurent
la
photoprotection,
tel
l’acide
urocanique
qui
est
un
produit
de
dégradation
de
la
filaggrine [7].
Barrière
immunitaire
La
peau
assure
une
barrière
immunitaire
à
l’interface
avec
l’environnement.
Le
système
immunitaire
cutané
est
composé
des
éléments
de
réponse
innée
et
acquise/adaptative [8].
Le
sys-
tème
immunitaire
inné
repose
essentiellement
sur
les
récepteurs
Toll-like
qui
sont
exprimés
à
la
fois
par
les
cellules
immuno-
compétentes
(cellules
de
Langerhans)
et
les
kératinocytes [9].
En
cas
de
contact
avec
les
éléments
de
surface
des
pathogènes,
les
récepteurs
Toll-like
enclenchent
la
production
des
molécules
immunomodulatrices
capables
d’induire
une
réaction
inflamma-
toire.
Cette
réponse
rapide
est
ensuite
complétée,
voire
amplifiée
par
une
réaction
immunitaire
ciblée,
suite
à
la
reconnaissance
des
motifs
antigéniques
spécifiques
de
pathogène
par
les
cel-
lules
immunocompétentes.
La
réponse
immunitaire
adaptative
est
plus
robuste
et
spécifique.
Les
cellules
de
Langerhans,
après
avoir
capté
le
stimulus
antigénique,
migrent
vers
les
ganglions
lymphatiques
régionaux
pour
transmettre
l’information
aux
lym-
phocytes
T
et
stimuler
la
production
des
cellules
effectrices
spécifiques
d’antigène.
Elles
assurent
donc
une
fonction
de
bar-
rière
immunitaire
adaptative
contre
les
antigènes
exogènes
à
la
peau.
“
Point
fort
Les
fonctions
photoprotectrice
et
immunitaire
de
l’épiderme
sont
respectivement
assurées
par
la
méla-
nine
et
l’acide
transurocanique,
d’une
part,
et
les
cellules
de
Langerhans
et
les
récepteurs
«
Toll-like
»,
d’autre
part.
Barrière
physique
et
chimique
de
la
couche
cornée
Durant
la
phase
terminale
de
leur
différenciation,
les
kérati-
nocytes
se
transforment
en
cornéocytes.
Ce
passage
se
fait
en
plusieurs
étapes
:
•
les
cellules
dans
les
dernières
assises
du
stratum
granulosum
larguent
plusieurs
constituants
dans
les
espaces
intercellulaires
;
•
les
cellules
dégradent
leurs
organites
et
s’aplatissent
tout
en
formant
des
enveloppes
cornifiées
rigides
;
•
les
jonctions
intercellulaires
sont
réticulées
à
la
périphérie
des
cornéocytes,
consolidant
ainsi
une
structure
pluricellulaire
stra-
tifiée [10,
11].
Le
stratum
corneum
(10
à
20
m
d’épaisseur)
est
formé
par
empilement
de
10
à
20
assises
de
kératinocytes
morts,
les
cor-
néocytes.
Le
stratum
corneum
est
en
renouvellement
constant,
la
perte
des
cellules
les
plus
externes
par
le
phénomène
de
desqua-
mation
étant
compensée
par
les
mitoses
dans
la
couche
basale
et
la
kératinisation
des
cellules
du
stratum
granulosum.
En
moyenne,
le
stratum
corneum
normal
se
renouvelle
tous
les
14
jours.
Une
barrière
efficace
du
stratum
corneum
repose
sur
une
adéquate
composition
biochimique
et
structurale
de
ces
divers
élé-
ments
constitutifs
et
se
caractérise
par
une
grande
interactivité
par
rapport
aux
influences
de
l’environnement.
L’architecture
géné-
rale
du
stratum
corneum
ressemble
à
celle
d’un
mur
composé
de
briques
et
de
ciment,
représentés
respectivement
par
les
cornéo-
cytes
et
les
lipides
intercornéocytaires [12],
bien
que
la
situation
soit,
en
réalité,
beaucoup
plus
complexe.
Ainsi,
la
partie
profonde
du
stratum
corneum
est
composée
des
cornéocytes
reliés
par
de
nombreuses
jonctions
et
ses
espaces
intercellulaires
sont
remplis
majoritairement
par
des
lipides
struc-
turés
en
multicouches.
C’est
précisément
cette
zone,
appelée
le
stratum
corneum
compactum,
qui
remplit
la
principale
fonction
de
barrière
hydrique
et
de
perméabilité.
Ensuite,
dans
le
stratum
corneum
disjunctum,
les
jonctions
intercellulaires
et
les
éléments
de
la
matrice
intercellulaire
sont
progressivement
dégradés,
ce
qui
amorce
le
processus
de
desquamation.
2EMC
-
Cosmétologie
et
Dermatologie
esthétique
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 09/06/2017 par UNIVERSITE PARIS VI - BIBLIOTHEQUE - (15258). Il est interdit et illégal de diffuser ce document.

Barrière
épidermique 50-020-B-10
Plusieurs
composantes
cellulaires
et
matricielles
sont
indispen-
sables
pour
que
la
fonction
barrière
du
stratum
corneum
soit
efficace.
Cytosquelette
des
cornéocytes
Les
kératines
sont
les
protéines
les
plus
abondantes
dans
les
kératinocytes
et
constituent
leur
cytosquelette.
On
distingue
deux
familles
de
kératines
:
les
kératines
acides
codées
par
le
chromo-
some
17q
(K9
à
K20)
et
les
kératines
neutres
et
basiques
codées
par
le
chromosome
12
(K1
à
K8).
Des
paires
de
kératines,
une
de
chaque
famille,
sont
nécessaires
pour
former
des
filaments
inter-
médiaires
(10
nm),
qui
participent
à
leur
tour,
sous
forme
des
faisceaux,
à
la
protection
de
l’épiderme
contre
les
stress
méca-
niques [13].
En
effet,
les
cytosquelettes
des
cellules
individuelles
se
trouvent
interconnectés
à
travers
des
jonctions
desmosomales
en
une
suprastructure,
ce
qui
confère
à
l’épiderme
une
cohésion
et
une
résistance
élastique.
Dans
le
stratum
corneum,
les
kéra-
tines
représentent
plus
de
85
%
des
protéines.
Ce
pourcentage
élevé
n’est
pas
seulement
dû
à
une
augmentation
de
la
synthèse
des
kératines
dans
les
couches
vivantes
supérieures
mais
aussi
à
leur
relative
résistance
à
la
dégradation
subie
par
d’autres
pro-
téines
du
cytoplasme
et
des
organites.
L’attachement
des
filaments
de
kératine
à
la
périphérie
des
cornéocytes
est
renforcé
par
les
phénomènes
de
réticulation
des
enveloppes
cornifiées.
Ainsi,
les
cytosquelettes
des
cornéocytes
participent
à
la
fonction
barrière
épidermique
de
par
leur
contribution
aux
propriétés
mécaniques
de
la
couche
cornée [14,
15].
Filaggrine
La
profilaggrine
est
l’une
des
protéines
codées
par
le
complexe
de
différenciation
épidermique
qui
s’active
à
des
stades
avan-
cés
de
la
kératinisation.
Ce
précurseur
de
la
filaggrine
est
stocké
au
niveau
du
stratum
granulosum
dans
les
grains
de
kératohya-
line
(d’où
le
nom
de
cette
couche
épidermique).
La
profilaggrine
est
un
complexe
protéique
très
phosphorylé
d’environ
500
KDa
conservant
le
domaine
N-terminal
(S100
calcium-binding
domain),
commun
à
d’autres
molécules
de
cette
famille
comme
la
horné-
rine
et
la
filaggrine
2,
suivi
du
«
domaine
B
»
et
d’une
série
de
monomères
de
filaggrine.
Lors
de
la
transition
entre
le
stratum
gra-
nulosum
et
stratum
corneum,
la
profilaggrine
est
déphosphorylée
et
clivée
par
différentes
enzymes,
telles
la
matriptase,
la
furine,
la
PACE4,
en
monomères
de
filaggrine [16].
La
filaggrine
(37
KDa)
est
capable
d’agréger
les
filaments
intermédiaires
de
kératine,
ce
qui
donne
aux
faisceaux
de
ces
filaments
un
aspect
condensé
et
amorphe
en
microscopie
électronique
à
transmission.
De
cette
fac¸on,
la
filaggrine
participe
au
renforcement
de
la
barrière
méca-
nique
des
cornéocytes.
Les
autres
fonctions
de
la
filaggrine,
ou
plutôt
des
produits
de
sa
dégradation,
sont
aussi
importantes.
La
dégradation
commence
par
la
conversion
des
résidus
d’arginine
en
citruline,
sur
la
filaggrine
et
les
filaments
de
kératines
asso-
ciés,
par
trois
peptidylarginine
désaminases
(PAD
1
à
3) [17].
La
désamination
contribue
à
la
dissociation
des
complexes
et
faci-
lite
l’attaque
d’autres
enzymes
de
clivage,
telle
la
caspase
14 [18].
La
filaggrine
est
dégradée
en
acides
aminés
hydrophiles
(gluta-
mine,
histidine
et
arginine)
ainsi
que
leurs
dérivés
désaminés
(acide
pyroglutamique,
acide
transurocanique,
etc.).
Les
premiers
participent
à
la
rétention
de
l’eau
à
l’intérieur
des
cornéocytes
et
jouent
ainsi
le
rôle
de
facteurs
naturels
d’hydratation
(natural
moisturizing
factors
[NMF]).
Les
NMF
intracellulaires
présentent
20
à
30
%
du
poids
sec
du
stratum
corneum.
Étant
majoritai-
rement
acides,
ils
contribuent
au
potentiel
hydrogène
(pH)
bas
du
stratum
corneum
avec
son
effet
antimicrobien.
Par
ailleurs,
les
peptides
issus
de
la
dégradation
enzymatique
de
la
filag-
grine
2
et
de
la
hornérine
possèdent,
quant
à
eux,
des
propriétés
bactéricides.
L’acide
transurocanique
est
connu
pour
son
pouvoir
photopro-
tecteur
par
absorption
des
UVB [7].
Sa
photoconversion
isomérique
en
forme
«
cis
»
fait
partie
d’effets
immunosuppresseurs
induits
par
l’exposition
de
la
peau
aux
rayons
UV [19].
“
Point
fort
Les
kératines
forment
le
cytosquelette
des
kératinocytes
et
constituent
la
famille
majoritaire
des
protéines
de
l’épiderme.
La
filaggrine
est
synthétisée
plus
tard
durant
la
différenciation
épidermique
et
consolide
les
faisceaux
des
filaments
de
kératine.
Sa
dégradation
en
acides
ami-
nés
dans
la
couche
cornée
est
à
l’origine
d’une
capacité
hygroscopique
importante
des
cornéocytes
et
contribue
au
pH
bas
de
la
surface
cutanée.
Enveloppes
cornifiées
Durant
la
kératinisation,
la
membrane
plasmique
des
kératino-
cytes
est
remplacée
par
une
monocouche
de
céramides
associés
à
une
structure
sous-jacente,
connue
sous
le
nom
d’enveloppe
cornifiée [20].
Les
enveloppes
cornifiées,
de
5
à
10
nm
d’épaisseur,
sont
relativement
rigides,
chimiquement
stables
et
insolubles
dans
l’eau.
Cette
structure
macromoléculaire
est
le
fruit
de
la
déposition
et
la
réticulation
de
plusieurs
protéines
à
la
face
interne
de
la
membrane
cellulaire
et
d’une
monocouche
d’hydroxycéramides--acétylés
(qui
remplacent
les
phospholi-
pides)
à
la
face
externe [20–23].
Les
protéines
impliquées
sont
des
marqueurs
de
différenciation
terminale
de
l’épiderme,
comme
la
loricrine,
l’involucrine
et
des
petites
protéines
riches
en
domaine
proline.
La
réticulation
des
protéines
et
des
lipides
est
catalysée
par
les
transglutaminases
1,
3
et
5.
Les
jonctions
intercellulaires
présentes
à
la
surface
des
cel-
lules
et
les
filaments
de
cytosquelette
qui
leur
sont
associés
se
trouvent
piégés
dans
la
matrice
réticulée
des
enveloppes
cornifiées
renforc¸ant
ainsi
la
structure
générale
de
la
couche
cornée [15].
Par
ailleurs,
la
monocouche
des
céramides
à
la
surface
des
enveloppes
sert
de
matrice
pour
l’accrochage
et
l’organisation
moléculaire
des
lipides
intercellulaires
du
stratum
corneum,
contribuant
ainsi
à
la
formation
du
«
ciment
»
hydrophobe
de
la
barrière
cornée.
Lipides
intercellulaires
Puisque
les
enveloppes
cornifiées
sont
imperméables
à
la
plu-
part
des
substances,
la
voie
de
pénétration
principale
permettant
de
franchir
le
stratum
corneum
demeure
la
voie
intercellulaire [12].
Les
espaces
intercellulaires
du
stratum
corneum
sont
remplis
de
lipides
sécrétés
par
les
kératinocytes
de
la
couche
granu-
leuse
à
l’interface
entre
l’épiderme
vivant
et
la
couche
cornée.
Les
différentes
espèces
lipidiques
s’auto-organisent
en
bicouches
superposées
parallèlement
aux
surfaces
des
cornéocytes.
La
composition
lipidique
détermine
la
qualité
d’organisation
lamel-
laire
et
constitue
le
facteur
clé
de
la
fonction
barrière
de
la
peau [24].
Dans
le
stratum
corneum
humain
normal,
les
lipides
sont
dis-
posés
sous
forme
de
deux
phases
lamellaires
coexistantes,
une
phase
à
périodicité
longue
et
une
phase
à
périodicité
courte,
avec
des
distances
de
répétition
respectives,
de
l’ordre
de
13
nm
et
de
6
nm [25,
26].
La
matrice
lipidique
est
principalement
composée
d’un
mélange
équimolaire
de
céramides
(CER)
(environ
50
%
en
poids),
d’acides
gras
libres
(environ
10
%
en
poids),
de
cholestérol
(environ
20
%
en
poids)
et
de
son
dérivé,
le
sulfate
de
cholestérol
(environ
5
%) [27–30].
Les
CER
jouent
un
rôle
clé
dans
le
fonction-
nement
de
la
barrière
cutanée [31].
Douze
sous-classes
de
CER,
avec
des
chaînes
de
longueurs
différentes,
ont
été
identifiées
à
ce
jour
dans
le
stratum
corneum
humain [32,
33].
En
général,
une
réduc-
tion
de
la
longueur
de
chaîne
des
CER
a
un
fort
impact
négatif
sur
l’organisation
lamellaire
lipidique,
et
donc
sur
la
perméabilité
du
stratum
corneum [34–36].
Chez
les
patients
atteints
de
dermatite
atopique,
une
réduction
de
la
longueur
de
chaîne
des
céramides
est
observée
et
est
en
corrélation
avec
l’altération
de
la
fonction
barrière [37].
Au
sein
même
des
feuillets
lipidiques,
à
la
température
de
surface
cutanée
autour
de
30
à
32 ◦C,
les
têtes
polaires
des
CER
présentent
majoritairement
une
organisation
latérale
EMC
-
Cosmétologie
et
Dermatologie
esthétique 3
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 09/06/2017 par UNIVERSITE PARIS VI - BIBLIOTHEQUE - (15258). Il est interdit et illégal de diffuser ce document.

50-020-B-10 Barrière
épidermique
orthorhombique
(phase
cristalline
solide).
Cependant,
les
lipides
peuvent
aussi
se
trouver
sous
forme
moins
dense,
dans
un
assem-
blage
à
motif
hexagonal
(gel
de
phase
cristalline)
ou
encore
dans
une
phase
plus
fluide
(la
phase
liquide),
qui
sont
les
formes
d’organisation
moins
pertinentes
du
point
de
vue
de
la
fonc-
tion
barrière [38–40].
Les
lipides
en
phase
liquide
sont
observés
en
plus
grand
nombre
dans
les
couches
les
plus
superficielles
du
stra-
tum
corneum,
probablement
à
cause
de
l’incorporation
du
sébum
sécrété
par
les
glandes
sébacées.
“
Point
fort
La
matrice
lipidique
de
la
couche
cornée
est
constituée
d’un
mélange
équimolaire
des
CER,
acides
gras
libres
et
cholestérol.
Les
CER
à
longues
chaînes
sont
indispensables
à
la
bonne
structuration
de
la
phase
lamellaire
des
lipides
intercornéocytaires,
et
donc
au
fonctionnement
efficace
de
la
barrière
de
perméabilité.
Cornéodesmosomes
Les
jonctions
intercellulaires
sont
indispensables
pour
le
bon
fonctionnement
des
tissus
épithéliaux.
Les
desmosomes,
associés
au
cytosquelette
de
kératines,
sont
les
jonctions
mécaniques
les
plus
nombreuses
et
les
plus
solides
dans
l’épiderme.
Lors
de
la
kératinisation,
leur
nombre,
taille
et
composition
évoluent [41,
42].
La
transition
entre
stratum
granulosum
et
stratum
corneum
est
accompagnée
par
l’incorporation
dans
la
partie
extracellulaire
des
desmosomes
d’une
protéine
nouvelle,
la
cornéodesmosine [43,
44].
Cette
modification
biochimique
explique
le
changement
d’aspect
morphologique
et
des
propriétés
mécaniques
de
la
jonction
qui,
dans
le
stratum
corneum,
est
appelée
cornéodesmosome [45,
46].
Les
cornéodesmosomes
sont
des
principaux
facteurs
de
cohésion
du
stratum
corneum
et
leur
dégradation
constitue
l’étape
cruciale
lors
du
processus
physiologique
de
desquamation
des
cornéocytes
à
la
surface
de
la
peau.
Peptides
antimicrobiens
Les
peptides
antimicrobiens
font
partie
de
la
défense
cutanée
non
spécifique [47].
Les
plus
importants
peptides
antimicrobiens
du
stratum
corneum
humain
sont
la
psoriasine
(S100A7,
RNase7
et
human
beta-defensins
[hBD]
1-3) [48].
La
plupart
de
ces
peptides
sont
facilement
inductibles
lors
de
la
rupture
du
stratum
corneum
et
à
la
suite
de
contact
avec
les
pathogènes
;
certains,
comme
RNase
7,
sont
constitutifs [49].
Dans
la
peau
humaine
normale,
la
majeure
partie
des
peptides
antimicrobiens
est
synthétisée
par
les
kératinocytes,
surtout
dans
le
stratum
granulosum,
où
ils
sont
stockés
dans
les
corps
lamellaires
et
sécrétés
à
l’interface
stratum
corneum/stratum
granulosum [50].
Les
glandes
sébacées
et
sudo-
ripares
ainsi
que
les
mastocytes
et
les
neutrophiles
dermiques
produisent
aussi
des
peptides
antimicrobiens.
Grâce
à
leur
charge
positive,
certains
peptides
antimicrobiens
s’attachent
et
s’insèrent
dans
les
membranes
chargées
négativement
des
bactéries
et
des
champignons,
créant
des
pores
et
provoquant
la
lyse
de
ces
agents
infectieux [51–53].
D’autres
peptides
antimicrobiens,
comme
psoria-
sin
ou
calprotectin,
agissent
par
séquestration
des
éléments
clés
(Zn2+,
Mn2+)
des
enzymes
utilisées
par
les
pathogènes.
Outre
leur
action
directe,
certains
peptides
antimicrobiens
possèdent
aussi
les
propriétés
immunomodulatrices [54].
Barrière
des
jonctions
serrées
Des
études
récentes
ont
suggéré
l’implication
des
jonctions
ser-
rées
de
la
couche
granuleuse
dans
la
fonction
barrière
cutanée,
d’une
part,
comme
barrière
secondaire
et,
d’autre
part,
à
cause
de
leur
participation
à
la
formation
du
stratum
corneum [55,
56].
Les
jonctions
serrées
sont
des
points
de
rapprochement
très
étroits
entre
les
feuillets
membranaires
externes
des
deux
cel-
lules
voisines.
Au
niveau
moléculaire,
les
jonctions
serrées
sont
composées
de
protéines
transmembranaires
spécifiques,
comme
l’occludine,
les
claudines,
Crumb
ou
JAM,
et
cytoplasmiques
(ZO-
1,
-2,
ZONAB,
Sec6/8)
liées
au
cytosquelette
d’actine [57,
58].
Comme
les
cornéodesmosomes,
les
jonctions
serrées
se
trouvent
réticu-
lées
lors
de
la
kératinisation
et
persistent
sous
forme
de
points
de
fusion
entre
les
enveloppes
cornifiées
des
cornéocytes
du
stra-
tum
corneum [59].
Ces
attaches
intercellulaires
participent
non
seulement
à
la
consolidation
du
stratum
corneum
mais
aussi
sub-
divisent
les
espaces
intercellulaires
dans
la
couche
cornée.
Cette
compartimentation
semble
être
importante
dans
la
régulation
de
la
desquamation
et,
par
conséquent,
pour
l’homéostasie
de
la
bar-
rière
cutanée.
Chez
l’homme,
plusieurs
travaux
ont
décrit
la
présence
des
protéines
et
des
structures
de
jonctions
serrées
au
niveau
du
stra-
tum
granulosum [57,
60,
61].
Certaines
de
ces
études
montrent
que
les
jonctions
serrées
épidermiques
constituent
une
barrière
contre
la
perméabilité
des
solutés
ioniques.
Ainsi,
les
jonctions
serrées
maintiennent
le
gradient
calcique,
indispensable
à
la
formation
des
jonctions
cellulaires
dans
l’épiderme
vivant.
Ce
même
gra-
dient
est
aussi
impliqué
dans
la
formation
de
la
barrière
primaire
lipidique
du
stratum
corneum.
En
effet,
l’exocytose
des
corps
lamellaires
à
travers
les
pôles
apicaux
des
kératinocytes
du
stra-
tum
granulosum
dépend
de
l’abrogation
du
gradient
calcique,
par
exemple
lors
de
la
rupture
de
la
couche
cornée [62].
Les
jonctions
serrées,
distribuées
autour
des
kératinocytes
du
stratum
granulo-
sum
contribuent
à
la
polarisation
de
ces
derniers
et
à
la
sécrétion
orientée
des
lipides [56].
Fonctionnement
de
la
barrière
épidermique
Le
bon
fonctionnement
de
la
barrière
épidermique
repose
sur
sa
structuration
morphologique
correcte
et
sa
composition
biochi-
mique
adéquate.
Les
conditions
changeantes
de
l’environnement
nécessitent
une
haute
adaptabilité
de
cette
structure
d’interface.
Cette
aptitude
à
évoluer
est
rendue
possible
grâce
au
renouvelle-
ment
constant
du
stratum
corneum
et
à
la
capacité
de
l’épiderme
à
réagir
à
des
situations
de
rupture
accidentelle
de
la
barrière.
En
effet,
tout
changement
de
perméabilité
du
stratum
corneum
est
perc¸u
par
les
couches
vivantes
et
résulte
en
réaction
proli-
férative
compensatoire
des
kératinocytes
basaux [63].
Aussi,
toute
perte
d’étanchéité
du
stratum
corneum,
qui
modifie
le
gradient
calcique
naturel,
entraîne
la
mise
en
œuvre
instantanée
du
sys-
tème
des
jonctions
serrées
dans
le
stratum
granulosum.
La
barrière
secondaire
des
jonctions
serrées,
complétée
et
renforcée,
parti-
cipe
à
l’orientation
polaire
de
l’excrétion
massive
du
contenu
des
corps
lamellaires
et
à
la
reconstitution
rapide
de
la
barrière
lipidique
à
l’interface
avec
le
stratum
corneum.
On
estime
que
1,2
cornéocytes
est
formé
toutes
les
24
heures
dans
l’épiderme
normal.
Ce
chiffre
peut
facilement
tripler
lors
des
situations
d’hyperprolifération
kératinocytaire
réactive
(inflammation)
ou
pathologique
(psoriasis).
Cela
démontre
la
capacité
importante
de
l’épiderme
à
restituer
la
couche
cornée
et
sa
fonction
de
barrière
(Fig.
2).
L’homéostasie
épidermique
en
général
et
le
renouvellement
constant
du
stratum
corneum
en
particulier
nécessitent
aussi
la
mise
en
place
du
processus
de
desquamation
hautement
régulé.
Les
cornéocytes
doivent
s’accumuler
à
la
surface
épider-
mique
dans
certaines
situations,
ou
desquamer
plus
rapidement
dans
d’autres,
tout
en
conservant
intacte
la
fonction
essen-
tielle
de
barrière.
La
cohésion
entre
les
cornéocytes
dépend
principalement
de
la
présence
des
cornéodesmosomes [64].
La
dégradation
ordonnée
de
ces
jonctions
intervient
sous
l’action
des
enzymes
protéolytiques
extracellulaires,
telles
les
kallikréines
(KLK
5,
7,
8,
14,
etc.),
et
intracellulaires,
comme
cathepsines
(C,
D,
E,
L,
L2,
etc.).
L’activité
protéolytique
est,
à
son
tour,
contrôlée
par
les
inhibiteurs
protéiques
spécifiques
(LEKTI
-1,
-
2,
SLPI,
elafin,
A2ML1,
cystatines
M/E,
A,
etc.)
mais
aussi
par
le
précurseur
de
cholestérol
(sulfate
de
cholestérol
converti
par
4EMC
-
Cosmétologie
et
Dermatologie
esthétique
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 09/06/2017 par UNIVERSITE PARIS VI - BIBLIOTHEQUE - (15258). Il est interdit et illégal de diffuser ce document.

Barrière
épidermique 50-020-B-10
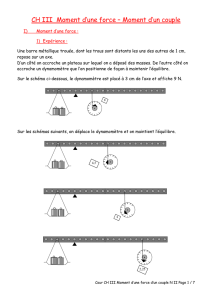
Barrière
photoprotectrice
Barrière
immunitaire
Barrière de
perméabilité
Barrière épidermique
Barrière du stratum
corneum
Barrière des jonctions
serrées du stratum
granulosum
pH Peptides
antimicrobiens
Cytosquelette et
filaggrine
Enveloppes
cornifiées
Jonctions
cellulaires
Lipides
extracellulaires
Cornification/
desquamation
(renouvellement)
Film hydrolipidique
de surface
(sébum et sueur)
Barrière physique Barrière chimique
Réponse innée
(récepteurs Toll-like)
Réponse immunitaire
acquise/adaptative
(cellules de Langerhans)
Mélanine
(mélanocytes) Acide urocanique
Figure
2.
Hiérarchie
des
constituants
de
la
barrière
épidermique.
pH
:
potentiel
hydrogène.
stéroïde
sulfatase)
et
le
pH [46,
65].
Par
ailleurs,
la
distribution
spatiale
des
molécules
interagissant
dans
l’espace
intercornéo-
cytaire
est
modulée
par
la
présence
plus
ou
moins
importante
des
résidus
des
jonctions
serrées
qui
cloisonnent
cet
espace
en
sous-compartiments [59].
D’autres
enzymes
cataboliques
sont
aussi
présentes
dans
le
stratum
corneum
et
contribuent
à
son
évolution
naturelle.
Les
glycosidases
convertissent
les
glycosylcéramides
(bêta-glucocérébrosidase)
et
la
sphingomyéline
(sphingomyéli-
nase
acide),
sécrétés
par
les
kératinocytes
du
stratum
granulosum,
en
céramides,
indispensables
pour
la
structuration
des
lipides
intercornéocytaires
;
elles
dégradent
aussi
les
glycannes
des
gly-
coprotéines
jonctionnelles,
facilitant
l’action
des
protéases [66].
La
lipase
acide,
phospholipase
A2
et
triacylglycérolipase
permettent
la
conversion
des
phospholipides
membranaires
et
triglycé-
rides
en
acides
gras
libres
et
glycérol [67],
contribuant
ainsi
à
l’acidification
du
stratum
corneum.
Les
différents
acteurs
actifs
chimiquement
dans
la
couche
cor-
née
(lipides,
peptides
et
protéines
structurelles,
enzymes
et
leurs
inhibiteurs,
etc.)
sont
sécrétés
dans
les
espaces
intercellulaires
à
l’interface
entre
stratum
granulosum
et
stratum
corneum
par
le
système
tubulovésiculaire
d’origine
golgienne
(corps
ou
granules
lamellaires,
kératinosomes).
Empaquetage
séparé
et
gradient
de
pH
jouent
un
rôle
important
dans
la
prévention
des
interactions
prématurées
entre
ces
éléments [62,
68].
L’espace
intercornéocytaire
du
stratum
corneum
est
presque
entièrement
rempli
par
les
lipides
lamellaires
qui
s’auto-organisent
aussitôt
après
l’excrétion.
Les
modèles
d’organisation
moléculaire
du
«
ciment
»
lipidique
ne
comportent
pas
d’espace
pour
les
molécules
d’eau [69].
Toute-
fois,
les
molécules
non
lipidiques,
de
nature
hydrophile,
doivent
aussi
y
trouver
leur
place.
En
effet,
des
lacunes
hydrophiles
insérées
dans
les
couches
lipidiques
et
réagissant
par
renfle-
ment
à
l’augmentation
de
l’humidité
ambiante
peuvent
être
visualisées
en
microscopie
électronique [70].
L’eau
étant
indispen-
sable
pour
l’activité
enzymatique
et
sa
régulation
par
le
pH,
on
“
Point
fort
Le
bon
fonctionnement
de
la
barrière
épidermique
repose
sur
sa
structuration
morphologique
correcte
et
sa
compo-
sition
biochimique
adéquate.
Cette
barrière
n’est
pas
une
structure
figée.
Au
contraire,
elle
s’adapte
de
manière
très
interactive
aux
changements
environnementaux.
comprend
alors
aisément
les
relations
entre
les
influences
de
l’environnement
et
le
fonctionnement
structure-dépendant
de
la
barrière
du
stratum
corneum [71].
Déclaration
d’intérêts
:
les
auteurs
déclarent
ne
pas
avoir
de
liens
d’intérêts
en
relation
avec
cet
article.
Références
[1]
Koster
MI,
Roop
DR.
Mechanisms
regulating
epithelial
stratification.
Annu
Rev
Cell
Dev
Biol
2007;23:93–113.
[2]
Henry
J,
Toulza
E,
Hsu
CY,
Pellerin
L,
Balica
S,
Mazereeuw-Hautier
J,
et
al.
Update
on
the
epidermal
differentiation
complex.
Front
Biosci
2012;17:1517–32.
[3]
Elias
P,
Feingold
K,
Fluhr
J.
Skin
as
an
organ
of
protection.
In:
Freedberg
IM,
Goldsmith
LA,
Katz
S,
Austen
KF,
Wolff
K,
editors.
Fitzpatrick’s
dermatology
in
general
medicine.
New
York:
McGraw-
Hill;
2003.
p.
107–18.
[4]
Afshar
M,
Gallo
RL.
Innate
immune
defense
system
of
the
skin.
Vet
Dermatol
2013;24,
32–8
e8–9.
[5]
Boissy
RE.
Melanosome
transfer
to
and
translocation
in
the
keratino-
cyte.
Exp
Dermatol
2003;12(Suppl.
2):5–12.
[6]
Plonka
PM,
Passeron
T,
Brenner
M,
Tobin
DJ,
Shibahara
S,
Thomas
A,
et
al.
What
are
melanocytes
really
doing
all
day
long...?
Exp
Dermatol
2009;18:799–819.
[7]
Mildner
M,
Jin
J,
Eckhart
L,
Kezic
S,
Gruber
F,
Barresi
C,
et
al.
Knockdown
of
filaggrin
impairs
diffusion
barrier
function
and
increases
UV
sensitivity
in
a
human
skin
model.
J
Invest
Dermatol
2010;130:2286–94.
[8]
Medzhitov
R,
Janeway
Jr
C.
Innate
immunity.
N
Engl
J
Med
2000;343:338–44.
[9]
Mempel
M,
Voelcker
V,
Kollisch
G,
Plank
C,
Rad
R,
Gerhard
M,
et
al.
Toll-like
receptor
expression
in
human
keratinocytes:
nuclear
factor
kappaB
controlled
gene
activation
by
Staphylococcus
aureus
is
toll-
like
receptor
2
but
not
toll-like
receptor
4
or
platelet
activating
factor
receptor
dependent.
J
Invest
Dermatol
2003;121:1389–96.
[10]
Eckhart
L,
Lippens
S,
Tschachler
E,
Declercq
W.
Cell
death
by
corni-
fication.
Biochim
Biophys
Acta
2013;1833:3471–80.
[11]
Haftek
M.
Kératinisation
épidermique.
EMC
(Elsevier
Masson
SAS,
Paris),
Dermatologie,
98-010-A-10,
2010.
[12]
Elias
PM.
Epidermal
lipids,
barrier
function,
and
desquamation.
J
Invest
Dermatol
1983;80(suppl):44s–9s.
[13]
Bousquet
O,
Coulombe
P.
Les
kératines
:
un
autre
regard
sur
la
biologie
de
la
peau.
Med
Sci
2002;18:45–54.
[14]
McLean
WH,
Moore
CB.
Keratin
disorders:
from
gene
to
therapy.
Hum
Mol
Genet
2011;20:R189–97.
EMC
-
Cosmétologie
et
Dermatologie
esthétique 5
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 09/06/2017 par UNIVERSITE PARIS VI - BIBLIOTHEQUE - (15258). Il est interdit et illégal de diffuser ce document.
 6
6
 7
7
 8
8
1
/
8
100%