Identification laparoscopique des ganglions sentinelles

19
La Lettre du Gynécologue - n° 303 - juin 2005
e concept de ganglion sentinelle (GS) n’est pas nou-
veau et son application aux cancers gynécologiques,
en particulier au cancer du col, a été décrite pour la
première fois il y a maintenant cinq ans (1).
Notre étude, prospective, multicentrique, a donc pour but d’éva-
luer, plus que la faisabilité, le réel intérêt et la place de cette tech-
nique dans la prise en charge thérapeutique des cancers du col à un
stade précoce.
Le recueil de données a débuté en avril 2001 au sein de trois
centres anticancéreux : le centre Oscar-Lambret (Lille), l’Institut
Claudius-Regaud (Toulouse) et l’hôpital européen Georges-
Pompidou (Paris).
Notre effectif est actuellement de 60 patientes qui présentaient,
dans la majorité des cas, un cancer du col à un stade I (1 IA1, 6
IA2, 49 IB1, 1 IB2), seules 3 patientes présentaient un stade IIB.
La procédure de détection est identique dans les trois centres
utilisant une injection de sulfure de rhénium marqué au 99mTc
(200 µCi) la veille de l’intervention suivie de deux clichés
lymphoscintigraphiques (précoce et tardif). Pour certaines
patientes, comme cela a été le cas à Toulouse, une technique
en cours d’évaluation utilisant la superposition de ces clichés à
des clichés scannographiques (technique de fusion d’images),
a permi d’améliorer le repérage anatomique des GS. Le jour de
l’intervention, le même opérateur réalise une injection intra-
cervicale de bleu patenté (2 ml dilués à 50%, soit 4 ml). Les
injections sont effectuées sur les rayons de 12 h, 3 h, 6 h et 9 h
du col utérin, à la même profondeur pour les deux marqueurs.
Le repérage cœlioscopique nécessite la mise en place d’un tro-
cart de 10 mm ombilical pour l’optique, de deux trocarts opé-
rateurs de 5 mm en fosse iliaque droite et gauche et d’un tro-
cart de 12 mm suspubien pour la sonde gamma endoscopique
et le retrait des ganglions.
L’exploration pelvienne débute au niveau de la région cervi-
cale en utilisant la sonde gamma endoscopique et en suivant
les lymphatiques bleutés. Après ouverture du ligament large,
les ganglions sentinelles bleus et/ou chauds sont prélevés élec-
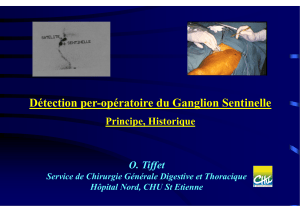
tivement et adressés pour examen extemporané (figure).
L’intervention se poursuit par la réalisation d’une lymphadé-
nectomie pelvienne bilatérale systématique. Si l’examen extem-
porané du curage retrouve une métastase ganglionnaire, une lym-
phadénectomie lomboaortique est réalisée dans le même temps
opératoire. Si l’examen extemporané du curage ne montre pas
d’envahissement ganglionnaire, une hystérectomie élargie est réa-
lisée dans le même temps pour les lésions de moins de 2 cm. Pour
les tumeurs de plus de 2 cm, la chirurgie est réalisée 6 semaines
après la curiethérapie première.
Au total, 183 GS ont été prélevés, soit une moyenne de 3 par
patiente, avec une moyenne de 16 ganglions dans le curage com-
plémentaire.
Le taux de détection global est comparable aux séries de la littéra-
ture qui utilisent une technique de détection combinée (80-
100%) : 93,3%, la détection étant bilatérale dans 66% des cas
(40 patientes sur 60). La combinaison des deux techniques de
repérage, isotopique et colorimétrique, permet d’obtenir un gain
de détection de 34% et de 13% respectivement, 53% des GS
étant bleus et chauds.
Identification laparoscopique des ganglions sentinelles
dans les stades précoces des cancers du col utérin : étude
prospective multicentrique de la technique de détection
combinant une injection de radiocolloïde et de bleu patenté
●É. Lambaudie
(1)
, F. Narducci
(1)
, É. Leblanc
(1)
, V. Samouelian
(1)
, F. Lécuru
(2)
, D. Querleu
(3)
1. Département de chirurgie oncologique, centre Oscar-Lambret, 3, rue
Frédéric-Combemale, 59000 Lille.
2. Département de chirurgie oncologique, hôpital européen Georges-
Pompidou, 20, rue Leblanc, 75015 Paris.
3. Département de chirurgie, Institut Claudius-Regaud, 20, rue du Point-Saint-
Pierre, 31052 Toulouse.
Detection of sentinel lymph nodes in early stage of cervical cancer:
a prospective multicentric study
L
Figure. Étapes du repérage laparoscopique des ganglions sentinelles.
DOSSIER

20
La Lettre du Gynécologue - n° 303 - juin 2005
DOSSIER
Parmi les 9 patientes qui présentaient une dissémination métasta-
tique ganglionnaire (15%), 4 avaient été détectées grâce au GS
prélevé en peropératoire, dont l’examen extemporané s’était
révélé positif, soit une sensibilité de 44%, sans autre ganglion
positif dans le curage complémentaire. En revanche, nous rele-
vons 5 faux négatifs qui se décomposent de la manière suivante :
•Un vrai faux négatif de la technique, le GS prélevé étant négatif,
mais un ganglion du curage complémentaire, ni bleu ni chaud,
étant le siège d’une micrométastase. À noter que le GS a été pré-
levé en présacré et que le ganglion positif était pelvien.
•Quatre faux négatifs de l’examen extemporané, les GS étant le
siège d’une micrométastase (2 cas) ou d’une métastase (2 cas) à
l’examen définitif, sans qu’aucun autre ganglion du curage ne soit
envahi.
Cette interprétation des résultats “par patiente” est celle qui est
employée dans la littérature. Elle est satisfaisante concernant le
taux de détection globale, mais met en évidence une sensibilité
très médiocre de la technique dans notre série, en partie liée aux
limites de l’examen extemporané. De plus, son interprétation est
partiellement fausse en raison des caractéristiques anatomiques du
col, dont le drainage lymphatique est en théorie bilatéral, malgré
les nombreuses variations interindividuelles (2, 3).
Si l’on envisage une détection “par hémipelvis”, comme
Barranger l’a aussi suggéré récemment (4), nous obtenons 5 N+ à
droite et 7N+ à gauche, soit une répartition sensiblement identique
(alors que le taux de détection bilatérale n’est que de 66%).
Nous retrouvons ainsi une sensibilité à droite de 80% (un seul
faux négatif lié à l’examen extemporané) et une sensibilité à
gauche de 15% (un vrai faux négatif, trois faux négatifs liés à
l’examen extemporané, deux ganglions métastatiques non
détectés mais avec un GS métastatique controlatéral dans les
deux cas qui auraient permis de corriger le diagnostic).
Bien que l’effectif de notre série soit encore faible, certaines
informations intéressantes émergent de nos résultats :
•La détection semble améliorée par la combinaison des tech-
niques radio-isotopique et colorimétrique, cette information
n’est pas nouvelle et a déjà fait l’objet de nombreuses publica-
tions. Il ne faut cependant pas perdre de vue les risques liés à l’uti-
lisation du bleu patenté qui, même exceptionnels, sont réels (désa-
turation, choc anaphylactique), rendant sont utilisation moins
systématique pour certains auteurs (5).
•La technique ne peut être appliquée qu’aux stades précoces et
donc aux stades I, les stades II étant à l’origine de deux échecs
de détection dans notre série (6).
•Le taux de détection global, même s’il est satisfaisant, ne doit
pas nous contenter. La détection doit avant tout être bilatérale.
Ainsi, si la technique devait être utilisée en routine, nos
constatations montrent que, si aucun ganglion n’était détecté,
un curage systématique devrait être réalisé.
•La sensibilité de la technique est, dans notre étude, de 44%, soit
bien inférieure à celle de l’examen extemporané sur le curage pel-
vien complet évaluée par Morice et al. (92,3%) (7).
L’utilisation en routine de la technique du GS dans le cancer du col
ne peut donc pas être envisagée au vu des résultats actuels. De
plus, dans environ 50 % de cas, il faudrait réaliser un curage pel-
vien d’un côté ou des deux côtés, soit en raison d’une détection
unilatérale, soit en raison d’un échec de repérage. Ces arguments
nous amènent à réfléchir sur l’intérêt même de la technique dans le
cancer du col, dont les avantages, en particulier en termes de mor-
bidité, ne peuvent être comparés à ceux obtenus dans le cancer du
sein.
Existe-t-il donc aujourd’hui un intérêt réel, tant pour la
patiente que pour le chirurgien, à se passer du “gold standard”
que constitue le curage pelvien ? ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Echt ML, Finan MA, Hoffman MS et al. Detection of sentinel lymph nodes
with lymphazurin in cervical, uterine, and vulvar malignancies. South Med J
1999;92(2):204-8.
2. Lécuru F, Neji K, Robin F et al. Lymphatic drainage of the uterus.
Preliminary results of an experimental study. J Gynecol Obstet Biol Reprod
1997;26 (4):418-23.
3. Michel G, Morice P, Castaigne D et al. Lymphatic drainage in stage IB and II
cervical cancers: anatomical study and surgical deductions. Contracept Fertil
Sex 1998;26(11):suppl VII-XI.
4. Barranger E, Fay S, Cortez A et al. Value of the sentinel node biopsy in ute-
rine cancers. Gynecol Obstet Fertil 2004;32(9):694-702.
5. Roy M. Communication libre SFOG 2004, Toulouse.
6. Malur S, Krause N, Kohler C, Schneider A. Sentinel lymph node detection in
patients with cervical cancer.Gynecol Oncol 2001;80(2):254-7.
7. Morice P, Sabourin JC, Pautier P et al. Indications and results of extempora-
neous examination of pelvic lymph nodes in the surgical strategy of stage Ib or
II cancers of the cervix uteri. Ann Chir 1999;53(7):583-6.
Dépistage du cancer du col utérin –Claude Gompel – Maloine
Le dépistage du cancer du col utérin est un exemple des failles qui existent
encore dans l’organisation de notre médecine. Alors que des méthodes de
dépistage et de traitement existent, des milliers de femmes meurent encore annuellement de ce cancer dans notre
pays. Cet ouvrage qui dresse un “état des lieux” des connaissances et données actuelles sur cette pathologie
s’adresse à tous les acteurs du dépistage : cliniciens, généralistes et gynécologues, anatomopathologistes, cytopa-
thologistes et cytotechniciens qui, très occupés par l’exercice de leur profession, souhaitent apprendre ou se
remémorer les notions essentielles du dépistage. Le rappel des recommandations cliniques et anatomopatholo-
giques simples (populations à risque, modes de prélèvements actuels, techniques de dépistage) devrait permettre
de répondre à cette faille inexcusable de la médecine actuelle.
LIVRES
1
/
2
100%