Lire l'article complet

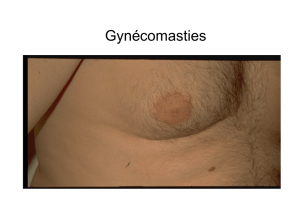
éfinie comme une prolifération glandulaire
bénigne du sein chez l’homme, la gynécomastie
est d’un diagnostic clinique relativement simple ;
elle est bien plus fréquente qu’on ne le pense.
Mais sous une apparente banalité, elle peut être révélatrice d’une
pathologie grave. Elle induit souvent un malaise physique ou
psychologique qui est le motif principal de consultation.
Les formes médicamenteuses deviennent de plus en plus fré-
quentes, ce qui oblige à les évoquer de parti pris ; après 50 ans,
la moitié des gynécomasties sont d’origine médicamenteuse (1).
INCIDENCE
Elle se rencontre surtout aux deux extrêmes de la vie : à l’ado-
lescence ou à un âge mur ; dans ces deux tranches d’âge, les
chiffres rapportés oscillent entre 30 et 60 % (2).
Heureusement, tous les hommes atteints de gynécomastie ne
viennent pas consulter…
La gynécomastie n’est pas associée à un risque accru de surve-
nue de cancer du sein, excepté dans le syndrome de Klinfelter.
PHYSIOPATHOLOGIE
Il n’existe pas de différence de réponse à la stimulation hormo-
nale entre la glande mammaire masculine ou féminine.
L’absence de développement du sein chez l’homme est bien
entendu secondaire à l’absence de sécrétion à des taux suffisants
d’estrogène et de progestérone.
Ainsi, la gynécomastie apparaîtra dès lors que sera créé un désé-
quilibre entre l’effet inhibiteur des androgènes et l’effet stimu-
lant des estrogènes. Les estrogènes produits chez l’homme
proviennent principalement du métabolisme périphérique de la
testostérone et de l’androstènedione par les aromatases. Celles-ci
sont situées dans le tissu adipeux mais aussi dans la glande
mammaire elle-même.
C’est donc l’augmentation du rapport estrogène/androgène qui
sera à l’origine de la gynécomastie. Une autre cause a parfois été
évoquée : l’hyperproduction de prolactine, dont la secrétion en
temps normal est réprimée par la dopamine. Cependant la gyné-
comastie est rare dans l’adénome à prolactine. Elle serait due, en
fait, non pas à un effet direct de la prolactine mais à l’insuffi-
sance gonadique secondaire induite par l’hyperprolactinémie.
Ainsi apparaissent tous les mécanismes pouvant être incriminés
dans l’apparition d’une gynécomastie :
– hyperproduction d’estrogènes, par une néoplasie testiculaire
ou surrénalienne ou par aromatisation périphérique excessive
des androgènes ;
– élévation de la fraction libre des estrogènes circulants par
diminution de leur dégradation ou déplacement de leurs pro-
téines de transfert (SHBG) ;
– diminution des androgènes circulants (synthèse, liaison à la
SHBG, dégradation) ;
– interactions dans la liaison des estrogènes ou des androgènes
avec leurs récepteurs ;
– perturbations dans la régulation de la prolactinémie (dopamine).
Il semblerait enfin que certaines gynécomasties puissent appa-
raître en présence de concentrations apparemment normales
d’estrogènes et d’androgènes ; elles seraient liées à une sensibilité
particulière du tissu mammaire à ces hormones. C’est en tout cas
ainsi que l’on “explique” les gynécomasties idiopathiques, qui
représentent tout de même 25 % des cas (1).
Les tableaux I et II résument les principales conditions patho-
logiques et les traitements médicamenteux pouvant être incri-
minés dans l’apparition d’une gynécomastie.
Seules les causes les plus fréquentes ont été volontairement rete-
nues.
7
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
La gynécomastie
●Jean-Rémi Garbay*
* Service des Ardennes, IGR, 39, rue Camille-Desmoulins, 94 805 Villejuif
Cedex. E-mail : [email protected]
D
•Physiologique néonatale, pubertaire, du vieillard
•Médicamenteuse ou toxique (voir tableau II)
•Hyperestrogénie aromatisation excessive
tumeur testiculaire (germinale, Leydig, Sertoli)
corticosurrénalome
obésité
hyperthyroïdie
insuffisance hépatique
cirrhose
hermaphrodisme
prise d’estrogènes (crèmes, lotions, etc.)
•Hypersécrétion choriocarcinome testiculaire
de B-HCG cancer pulmonaire, hépatique, rénal, gastrique
•Hypoandrogénie insuffisance gonadique primaire ou secondaire
circulante (Klinefelter, orchite, etc.)
insuffisance hypothalamo-hypophysaire
•Autres insuffisance rénale chronique
insuffisance cardiaque
VIH
zona
pathologie neurologique
•Idiopathique
Tableau I. Principales pathologies pouvant entraîner une gynécomastie,
classées selon leur physiopathologie (selon [9]).

DOSSIER
8
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
HISTOLOGIE
Sur le plan histologique, on oppose la gynécomastie floride liée
à une prolifération glandulaire, qui peut parfois s’accompagner
d’une hyperplasie épithéliale à la limite de l’atypie, et la gyné-
comastie fibreuse liée à une prolifération stromale majeure, d’où
une fibrose diffuse.
En général, la gynécomastie floride correspond à la première
phase d’apparition, et c’est à ce stade que les douleurs sont le
plus fréquentes.
En l’absence de traitement spécifique, on observe au bout d’un
an environ une transformation fibreuse du stroma qui conduit au
deuxième type de gynécomastie, en général indolore.
DIAGNOSTIC
Les circonstances de découverte sont parfois des douleurs ou une
sensibilité excessive, et bien entendu une augmentation de
volume du sein qui est unilatérale une fois sur deux.
La gynécomastie doit être distinguée essentiellement de deux
autres situations :
– l’adipomastie, ou pseudogynécomastie, qui est une augmen-
tation de volume mammaire d’origine essentiellement graisseuse,
dans un contexte de surcharge pondérale. Il n’y a en général
aucune douleur à la palpation, l’ensemble du sein est extrême-
ment mou, alors que dans la gynécomastie, on palpe un placard
dense, arrondi, correspondant à l’hypertrophie glandulaire ;
– le cancer du sein. Bien que rare chez l’homme, il doit natu-
rellement être systématiquement évoqué, étant donné les consé-
quences d’une erreur de diagnostic (voir article de B. Cutuli).
Le caractère unilatéral souvent excentré par rapport à l’aréole
beaucoup plus dur permettra parfois de suspecter le diagnostic.
Celui-ci sera aisé en cas de rétraction cutanée ou aréolaire, en
cas d’écoulement ou d’adénopathie axillaire, qui sont très rare-
ment associés à une gynécomastie.
Cependant, le tableau clinique peut rester peu spécifique.
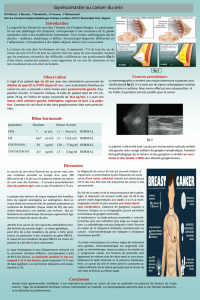
La mammographie est d’une aide moyenne au diagnostic ; sa
valeur prédictive négative est de 55 % seulement (3). En effet,
elle montre souvent une image spiculée qui, prise isolément,
peut inquiéter, comme on le voit sur l’un des côtés de l’image.
Lorsque cette image est rétroaréolaire et que l’examen clinique
est évocateur de gynécomastie (pas de rétraction cutanée,
notamment), elle ne doit pas être considérée comme suspecte.
En revanche, située à distance de l’aréole, elle devient suspecte
de carcinome.
Aussi, il ne faudra pas hésiter à effectuer une cytoponction (4)
ou un tru-cut pour examen histologique. La fiabilité de la cyto-
ponction est diversement appréciée, selon les auteurs ; il existe
Figure. Mammographie bilatérale d’un homme de 33 ans. Opacités
régulières rétro-mammelonnaires. Gynécomastie bilatérale, probable-
ment médicamenteuse. Noter l’assymétrie, fréquente.
Médicaments Mécanisme
Antihistaminiques H2
Cimétidine Liaison aux récepteurs androgéniques
Ranitidine, famotidine
Oméprazole Inhibition des cytochromes P450 et
du catabolisme des estrogènes
Dompéridone Antidopaminergique "prolactine
Métoclopramide " prolactine très fréquente
Neuroleptiques :
– Phénothiazines, thioridazines, "prolactine très fréquente
benzamides
– Diazépam "estradiol circulant
Inhibiteurs calciques :
Vérapamil, nifédipine, diltiazem "prolactinémie; chez certains
le mécanisme reste obscur
Digitaliques Effet estrogènes-like
mais mal documenté
Spironolactone Blocage de la synthèse de la testostérone
" estrogènes sériques
Canrénoate
Captopril
Estrogènes "estrogènes circulants
Antiandrogènes
Cyprotérone, finastéride Blocage de la liaison aux récepteurs
cytosoliques
Hormone de croissance Activité lactogène de l’hormone
de croissance ou augmentation
de la sensibilité des cellules de Leydig
aux gonadotrophines
Agonistes LH-RH Suppression progressive de la sécrétion
androgénique
Androgènes et stéroïdes anabolisants
Chimiothérapie
Alkylants surtout mais aussi Destruction des cellules de Leydig
nitroso-urées, alcaloïdes
de pervenche, bléomycine
Kétoconazole Inhibition des 17 et 20 B-hydroxylases
Minocycline
Cas ponctuels :
Antidépresseurs tricycliques,
auranofin, bézafibrate,
ciprofloxacine, cordarone,
pénicillamine, éthionamide,
isoniazide, αméthyl-dopa,
phénytoïne, statines, vitamine E
Tableau II. Médicaments responsables de gynécomastie chez l’adulte,
classement par familles thérapeutiques (selon [1]).

9
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
environ 15 % de prélèvements jugés comme non contributifs (4)
et la présence d’atypies épithéliales n’est pas exceptionnelle (5).
En pratique, lorsque le tableau clinique et mammographique est
typique de gynécomastie, la cytologie n’est pas indispensable ;
mais il faut la réaliser au moindre doute ainsi qu’un tru-cut ou
une exérèse si la cytologie ne permet pas de conclure.
La responsabilité d’une prise médicamenteuse ou toxique doit
être validée par une démarche d’imputabilité : médicament
reconnu, chronologie, effet de l’arrêt du traitement, voire de sa
réintroduction, absence d’autre cause. Si tel est le cas, cela per-
mettra d’éviter des examens complémentaires inutiles. L’unila-
téralité n’est pas un argument contre une cause médicamenteuse.
GYNÉCOMASTIES IATROGÈNES
Elles étaient observées surtout dans le traitement du cancer de la
prostate (6). Aujourd’hui, elles sont aussi rapportées chez des
patients séropositifs sous traitement antirétroviral intensif (7, 8).
Diagnostic étiologique
Celui-ci peut naturellement aller d’un diagnostic simple à une
situation très complexe, étant donné la multiplicité des causes
envisageables.
En pratique, en fait, la démarche initiale doit rester relativement
simple et réalisable par n’importe quel praticien. Elle permet de
découvrir les causes les plus fréquentes et aussi les plus graves.
➣l’interrogatoire sera soigneux, permettant naturellement de
lister les médicaments et les drogues pouvant être impliqués,
mais aussi à la recherche d’un hypogonadisme, d’une hyper-
thyroïdie, de signes d’insuffisance rénale ou hépatique, d’une
atteinte neurologique.
➣sur le plan clinique, même dans un contexte de gynécomastie
pubertaire évidente, il faut absolument réaliser une palpation
abdominale à la recherche d’une masse (surrénales) et surtout un
examen soigneux des testicules pour éliminer une tumeur testi-
culaire.
Au moindre doute, l’échographie testiculaire est extrêmement
performante.
•À ce stade, deux situations sont déjà clairement individua-
lisables :
– Une cause médicamenteuse.
Si la suspicion est forte, on peut interrompre le produit (ce qui
est parfois difficile) et évaluer après 1 à 2 mois, sans autre exa-
men.
– Une gynécomastie pubertaire idiopathique.
Le plus important sera de rassurer l’adolescent et de le revoir à
3 mois, puis à 6 mois pour s’assurer de la régression.
•Dans tous les autres cas, quelques examens sont essentiels :
– une cytologie ou une histologie de la glande ;
– une biologie hépatique, rénale et thyroïdienne ;
– un dosage des bêta-HCG, testostérone, estradiol et éventuelle-
ment FSH et LH. Le dosage des bêta-HCG permet de suspecter
une tumeur germinale testiculaire ou autre.
Si tous ces premiers dosages sont normaux, ainsi que l’examen
testiculaire, en l’absence de cause médicamenteuse, le diagnos-
tic de gynécomastie idiopathique devient très probable.
Autrement, les tests biologiques auront permis de découvrir
l’une des principales causes endocriniennes : tumeur testiculaire,
hypogonadisme primaire, hyperprolactinémie, hyperthyroïdie.
Les autres examens deviennent affaire de spécialiste et seront
naturellement guidés par ce premier bilan.
Traitement
Il est important de souligner d’emblée que beaucoup de gyné-
comasties vont régresser spontanément, notamment en période
pubertaire mais aussi chez l’homme âgé.
Un traitement interventionniste sera donc surtout utile en cas de
gynécomastie symptomatique, soit en raison de tensions, de dou-
leurs, gênant le patient dans sa vie de tous les jours, soit en cas
de mauvaise tolérance psychologique en dehors de la puberté.
Il est important de souligner que la gynécomastie floride et sou-
vent symptomatique pourra répondre à un traitement andro-
génique, alors qu’en phase fibreuse, ce traitement sera beaucoup
moins efficace.
•Chirurgie
S’il s’agit d’une adipomastie (ou pseudo-gynécomastie), la tech-
nique chirurgicale la plus adaptée est la lipoaspiration ; elle est
très efficace, avec une rançon cicatricielle minime, et n’empêche
nullement un examen histologique de principe.
En cas de gynécomastie vraie, le geste consistera en une mas-
tectomie subtotale sous-cutanée par une incision périaréolaire,
conservant la plaque aréolo-mamelonnaire.
La chirurgie peut être indiquée d’emblée lorsqu’il existe une his-
toire clinique ancienne de gynécomastie idiopathique et, à
l’inverse, après échec d’un traitement médical suffisamment pro-
longé.
•Traitement médical
Ce traitement est envisagé après avoir formellement éliminé un
carcinome ou une adipomastie.
Il sera proposé aux gynécomasties sans cause organique ou
médicamenteuse.
Il doit être assez rapidement instauré en cas de symptomatologie
douloureuse.
Le traitement le plus fréquemment proposé est une pommade à
base de dihydrotestostérone (Andractim®). Ce traitement est effi-
cace dans plus de 3/4 des cas et entraîne une disparition com-
plète de la gynécomastie dans environ 25 % des cas.
L’efficacité antalgique est obtenue rapidement.

DOSSIER
10
La Lettre du Sénologue - n° 17 - juillet/août/septembre 2002
La testostérone orale peut avoir aussi une bonne efficacité, mais
elle est souvent moins choisie en raison du risque d’effets secon-
daires généraux et du risque d’aromatisation périphérique. De
même, le danazol (Danatrol®) est efficace mais peut entraîner
beaucoup d’effets secondaires chez l’homme.
Un autre traitement évalué est le tamoxifène à la dose de 10 mg,
2 fois par jour.
Quelques publications rapportent une efficacité importante, mais
les effectifs sont très faibles.
Enfin, théoriquement, les nouvelles antiaromatases (anastrozole
et létrozole) devraient être très efficaces dans cette situation,
mais l’on manque de données à l’heure actuelle.
CONCLUSION
Devant un patient présentant une gynécomastie, il faudra
toujours prendre le temps d’un interrogatoire soigneux et d’un
examen clinique complet (cou, abdomen, testicules).
Cela permettra de sélectionner les patients devant bénéficier
d’examens complémentaires.
Une cytologie ou une biopsie au moindre doute permettra de ne
pas passer à côté du cancer.
Il faut rappeler qu’il n’y a aucun examen complémentaire per-
mettant de retenir une étiologie médicamenteuse ou toxique ;
c’est dire l’importance de la démarche d’imputabilité.
Les médicaments le plus fréquemment responsables sont les
antiH2 (cimétidine), les digitaliques, la spironolactone, le véra-
pamil.
Les traitements médicaux sont efficaces surtout au début de la
gynécomastie.
La chirurgie reste un recours fréquent. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Hugues FC, Gourlot C, Le Jeunne C. [Drug-induced gynecomastia]. Ann
Med Interne (Paris) 2000 ; 151 : 10-7.
2. Gill MS, Kayani N, Khan MN, Hasan SH. Breast diseases in males, a mor-
phological review of 150 cases. J Pak Med Assoc. 2000 ; 50 : 177-9.
3. Evans GF, Anthony T, Appelbaum AH et al. The diagnostic accuracy of
mammography in the evaluation of male breast disease. Am J Surg 2001 ; 181 :
96-100.
4. Siddiqui MT, Zakowski MF, Ashfaq R, Ali SZ. Breast masses in males : multi-
institutional experience on fine-needle aspiration. Diagn Cytopathol 2002 ; 26 :
87-91.
5. Amrikachi M, Green LK, Rone R, Ramzy I. Gynecomastia : cytologic features
and diagnostic pitfalls in fine needle aspirates. Acta Cytol 2001 ; 45 : 948-52.
6. McLeod DG, Iversen P. Gynecomastia in patients with prostate cancer : a
review of treatment options. Urology 2000 ; 56 : 713-20.
7. Benveniste O, Simon A, Herson S. Successful percutaneous dihydrotestosterone
treatment of gynecomastia occurring during highly active antiretroviral therapy :
four cases and a review of the literature. Clin Infect Dis 2001 ; 33 : 891-3.
8. Qazi N, Morlese J, King DM et al. Diagnosis and management of male breast
enlargement in patients with HIV/AIDS. AIDS Read 2000 ; 10 : 703-8.
9. Mathur R, Braunstein GD. Gynecomastia : pathomechanisms and treatment
strategies. Horm Res 1997 ; 48 : 95-102.
DOSSIER THÉMATIQUE
Retrouvez dans notre prochain numéro
La Lettre du Sénologue
parution décembre 2002,
notre dossier :
PSYCHO-ONCOLOGIE
PSYCHO-ONCOLOGIE
Coordonné par J.M. Dilhuydy, I. Piollet-Calmette
1
/
4
100%