L Gynécomastie iatrogène : une nouvelle

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XXI - n° 5-6 - mai-juin 2017
120
Cas clinique
* Service d’endocrino-
logie-diabétologie,
CHU de Caen.
Gynécomastie iatrogène : une nouvelle
molécule à ajouter à la liste ?
Émilie Deberles*, Michael Joubert*, Yves Reznik*
L
a gynécomastie est une affection fréquente chez
l’homme aux différents âges de la vie. Une des
principales étiologies est iatrogène (6 à 27 % des
cas selon les séries), et les molécules le plus souvent
impliquées sont la spironolactone, les antiandrogènes
(acétate de cyprotérone), les trithérapies contre le VIH,
la cimétidine, les chimiothérapies à toxicité testiculaire
(agents alkylants), la rifampicine, la digoxine, l’amio-
darone, les inhibiteurs de l’enzyme de conversion de
l’angiotensine ou encore les psychotropes (1-3). De
nombreux autres médicaments sont listés comme
potentiellement responsables de gynécomastie, mais
avec une fréquence rare, voire anecdotique (tableau).
Nous rapportons ici un cas rare de gynécomastie iatro-
gène probablement dû à un traitement par simva statine.
Un patient de 59 ans consulte pour une sensibilité mam-
maire droite d’apparition récente. Ses antécédents sont
représentés par un diabète de type I présent depuis
39 ans, traité par pompe à insuline et bien équilibré
(HbA1c autour de 7 % depuis plusieurs années). Il pré-
sente également une stéatose hépatique d’étiologie
indéterminée (sérologies et bilan auto- immun négatifs)
responsable d’une élévation chronique des γ-GT depuis
une quinzaine d’années. Enfin, en raison d’une hyper-
cholestérolémie (LDL-c > 1,60 g/l), un traitement par
simvastatine 10 mg/j est instauré depuis 5 ans.
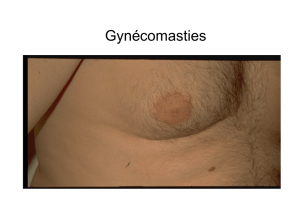
L’examen clinique révèle en effet une gynécomastie
rétroaréolaire droite de 2,5 cm de diamètre, ferme, sen-
sible. On soupçonne également une minime gynéco-
mastie à gauche. L’examen des organes génitaux ne
révèle aucune anomalie ; les testicules sont de taille
et de consistance normales. L’interrogatoire orienté ne
retrouve pas de signes d’hypogonadisme. La sexualité
semble également normale, avec une libido conservée,
des érections et des éjaculations jugées satisfaisantes
par le patient. L’examen clinique est par ailleurs normal :
le poids est stable, de 70 kg pour une taille de 1,84 m
(IMC = 20,6 kg/m2), et la pression artérielle est normale,
à 125/75 mmHg.
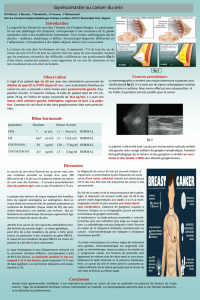
Le bilan biologique montre des γ-GT élevés, à 243 UI/l
(versus 195 UI/l sur les bilans précédents ; N < 55), des
phosphatases alcalines à 100 UI/l (30 ≤ N ≤ 120), des
TGO à 43 UI/l (N < 50), des TGP à 49 UI/l (N < 50), une
bilirubine totale normale à 13 µmol/l, un TP à 87 %, un
facteur V à 109 % et une albuminémie normale à 44 g/l.
Le bilan hormonal montre une testostéronémie totale
normale, à 4,85 ng/ml (1,75 ≤ N ≤ 7,81). L’estradiolémie
est modérément élevée, à 64 pg/ml (20 ≤ N ≤ 47), ainsi
que le taux de TeBG (Testosterone-Binding Globulin), à
100 nmol/l (14,5 ≤ N ≤ 48,4). Les gonadotrophines sont
normales : FSH = 11,6 UI/l (1,2 ≤ N ≤ 19,2), LH = 7,9 UI/l
(1,2 ≤ N ≤ 8,6). La prolactinémie est très modérément
élevée, à 21 ng/ml (3 ≤ N ≤ 16). L’hCG est indétectable.
Par ailleurs, la fonction thyroïdienne est normale
(TSH = 3,48 mUI/l [0,4 ≤ N ≤ 3,5], T3 = 4,05 pmol/l
[3,85 ≤ N ≤ 6,01], T4 = 10,6 pmol/l [7,9 ≤ N ≤ 14,4]).
L’IGF-1 est normale pour l’âge (71 ng/mm ; 55 ≤ N ≤ 203).
Les sérologies hépatiques, le bilan auto-immun, le bilan
martial et la cuprémie sont répétés, et leur normalité
est confirmée.
La mammographie et l’échographie mammaire
montrent un épaississement rétroaréolaire de nature
glandulaire bilatéral prédominant à droite, confirmant
la gynécomastie. Aucun élément pouvant faire sus-
pecter une malignité n’est retrouvé sur ces 2 examens.
L’échographie testiculaire est normale. L’IRM hypo-
physaire ne montre aucune anomalie. La radiographie
thoracique et le scanner des surrénales sans et avec
injection de produit de contraste sont également nor-
maux. L’IRM hépatique retrouve 2 kystes biliaires de 1
et 3 mm, d’allure banale.
Compte tenu des perturbations du bilan hépatique,
sans cause retrouvée d’hépatopathie, une origine
médicamenteuse est suspectée, et la simvastatine est
interrompue.
Six mois plus tard, le patient ne se plaint plus de sa
gynécomastie et déclare qu’elle a disparu. En effet, à
l’examen clinique, on constate une nette diminution de
la gynécomastie droite, avec la perception d’un petit
nodule résiduel rétroaréolaire. À gauche, la palpation
mammaire s’est complètement normalisée. Un bilan
biologique de contrôle est réalisé : l’estradiolémie s’est
normalisée à 31 pg/ml ; la prolactinémie est à 18 ng/ml,
la testostéronémie, à 4,29 ng/ml. La TeBG reste cepen-
dant toujours élevée, à 102 nmol/l. Le bilan hépatique
s’améliore, avec des γ-GT à 149 UI/l, des phosphatases
alcalines à 61 UI/l, des TGO à 34 UI/l, des TGP à 23 UI/l,
une bilirubine totale à 12 µmol/l. Le taux de LDL se

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XXI - n° 5-6 - mai-juin 2017
121
Gynécomastie iatrogène : une nouvelle molécule à ajouter à la liste ?
maintient à 1,37 g/l, grâce à des mesures diététiques
bien conduites. Compte tenu de l’absence d’autre
facteur de risque cardiovasculaire, aucun traitement
hypolipémiant n’a été réintroduit à ce jour.
Dans cette observation, afin de conforter l’hypothèse
du lien entre la prise de simvastatine et la survenue de
la gynécomastie, il aurait fallu faire un test de réintro-
duction de la molécule afin d’observer une éventuelle
récidive. Ce test n’a pas été réalisé, mais la responsablité
de la statine est pourtant très probable, compte tenu :
✓
de l’absence d’autre cause classique de gynéco-
mastie malgré un bilan assez large ;
✓de la régression de la gynécomastie ;
✓de l’amélioration du bilan hépatique à l’arrêt de la
statine.
Cependant, on est surpris dans cette observation par
plusieurs éléments. Tout d’abord, alors que la prise de
nombreux médicaments a pu être associée à la surve-
nue d’une gynécomastie (tableau), le lien entre statine
et gynécomastie n’est que très rarement rapporté, et
son mécanisme potentiel n’est pas connu. Les statines
agissent au niveau hépatique en inhibant l’HMG-CoA
réductase, qui transforme l’acide mévalonique en
cholestérol. Leur toxicité classique est principalement
hépatique et musculaire. Quelques cas de gynécomas-
tie sous statine ont été rapportés, mais aucun à notre
connaissance sous simvastatine. En 2010, Roberto et al.
ont rapporté 9 cas de gynécomastie chez 1 334 hommes
souffrant d’effets indésirables des statines (rosuvasta-
tine, atorvastatine et fluvastatine) [4]. M.K. Picolos et
al. rapportent la même année un cas de gynécomastie
sous rosuvastatine (5). Dans ces différents cas, le délai
d’apparition de la gynéco mastie après la mise en route
d’un traitement par statine était de 2 à 6 mois (6-8).
Selon notre observation, le délai entre l’instauration
du traitement par statine et la survenue de la gynéco-
mastie est plus long (5 ans). Dans toutes ces études, le
mécanisme supposé était la suppression de la produc-
tion surrénalienne ou gonadique de stéroïdes, consé-
cutive à la diminution de la synthèse du cholestérol
(nécessaire à la stéroïdogenèse). Pourtant, dans un
essai randomisé contrôlé contre placebo réalisé chez
des enfants et des adolescents traités par statine, les
concentrations plasmatiques des stéroïdes et le déve-
loppement pubertaire n’étaient pas différents dans les
2 groupes (9). En revanche, une autre étude, menée
chez des hommes diabétiques de type 2, a montré une
diminution de la TeBG et de la testostérone totale sous
l’effet de l’atorvastatine, sans modification de la testo-
stérone biodisponible. Dans cette même étude, l’effet
de la simvastatine a également été testé, mais aucune
modification n’a été observée avec celle-ci. Ce résultat
suggère donc l’absence d’effet de classe des statines sur
les stéroïdes sexuels mais un effet spécifique à chaque
molécule (10).
Le taux de TeBG dans notre observation mérite égale-
ment d’être commenté. La TeBG est une protéine syn-
thétisée par le foie qui lie diverses hormones, dont la
testostérone et l’estradiol. La TeBG a une affinité plus
Tableau. Principaux médicaments pour lesquels une association avec une gynécomastie a été
décrite (d’après [1] et [2]).
Antiandrogènes et
inhibiteurs
de la synthèse
des androgènes
Acétate de cyprotérone
Flutamide, bicalutamide, nilutamide
Finastéride, dutastéride
Spironolactone
Kétoconazole
Traitements anti-VIH (éfavirenz, antiprotéases)
Huile de lavande
Huile d’arbre à thé
Antibiotiques Éthionamide
Isoniazide
Métronidazole
Antiulcéreux Cimétidine, ranitidine
Oméprazole
Agents
chimiothérapeutiques
Agents alkylants
Méthotrexate
Vincristine
Cisplatine
Imatinib
Traitements
cardiovasculaires
Inhibiteurs de l’enzyme de conversion : captopril, énalapril
Amiodarone
Inhibiteurs calciques : diltiazem, nifédipine
Digoxine
Méthyldopa
Réserpine
Toxiques Alcool
Amphétamines
Héroïne
Méthadone
Marijuana
Hormones Androgènes
Estrogènes
Stéroïdes anabolisants
Hormone chorionique gonadotrope (hCG)
Hormone de croissance
Psychotropes Diazépam
Halopéridol
Phénothiazines
Antidépresseurs tricycliques
Antipsychotiques atypiques
Autres Métoclopramide
Dompéridone
Diéthylpropion
Phénytoïne
Théophylline
Étrétinate
Pénicillamine
Sulindac

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XXI - n° 5-6 - mai-juin 2017
122
Cas clinique
1. Deepinder F, Braunstein GD. Drug-induced gynecomastia: an
evidence-based review. Expert Opin Drug Saf 2012;11(5):779-95.
2. Thompson DF, Carter JR. Drug-induced gynecomastia.
Pharmacotherapy1993;13(1):37-45.
3. Meyer P. Évaluation et prise en charge d’une gynécomastie.
Revue médicale suisse. https://www.revmed.ch/RMS/2009/
RMS-198/Evaluation-et-prise-en-charge-d-une-gynecomastie
4. Roberto G, Biagi C, Montanaro N et al. Statin-associated
gynecomastia: evidence coming from the Italian spontaneous
ADR reporting database and literature. Eur J Clin Pharmacol
2012;68(6):1007-11.
5.
Picolos MK, Zeniou V, Michalis A. Rosuvastatin-induced
gynaecomastia. Clin Endocrinol 2010;73(3):421-2.
6. Oteri A, Catania MA, Travaglini R et al. Gynecomastia
possibly induced by rosuvastatin. Pharmacotherapy
2008;28(4):549-51.
7. Aerts J, Karmochkine M, Raguin G. [Gynecomastia due to
pravastatin]. Presse Med 1999;28(15):787.
8.
Hammons KB, Edwards RF, Rice WY. Golf-inhibiting gyneco-
mastia associated with atorvastatin therapy. Pharmacotherapy
2006;26(8):1165-8.
9. Romao I, Klass E. Gynecomastia. N Engl J Med
2007;357(25):2636; author reply 2636-7.
10. Stanworth RD, Kapoor D, Channer KS et al. Statin the-
rapy is associated with lower total but not bioavailable or
free testosterone in men with type 2 diabetes. Diabetes Care
2009;32(4):541-6.
11. Czajka-Oraniec I, Zgliczyński W. [Phenotype of patients
with gynecomastia]. Endokrynol Pol 2008;59(2):131-9.
12.
Kinkel K, Taïeb S, Boyer B. La gynécomastie en pratique
clinique. Imag Femme 2007;17(4):291-2.
13.
Donadille B. Comment prendre en charge une gynéco-
mastie ? http://symphomed.superforum.fr/t310-comment-
prendre-en-charge-une-gynecomastie.
14.
Peter A, Kantartzis K, Machann J et al. Relationships of
circulating sex hormone-binding globulin with metabolic
traits in humans. Diabetes 2010;59(12):3167-73.
15. Nestler JE. Sex hormone-binding globulin: a marker for
hyperinsulinemia and/or insulin resistance? J Clin Endocrinol
Metab 1993;76(2):273-4.
16. Danielson KK, Drum ML, Lipton RB. Sex hormone binding
globulin and testosterone in individuals with childhood dia-
betes. Diabetes Care 2008;31(6):1207-13.
17. Schlienger JL, Dale G, Chenard MP. Gynécomastie
par mastopathie diabétique : deux cas. Rev Med Interne
2001;22(3):307-8.
Références
E. Deberles déclare ne pas
avoir de liens d’intérêts.
Les autres auteurs n’ont pas
précisé leurs éventuels liens
d’intérêts.
importante pour la testostérone que pour l’estradiol ;
ainsi, une augmentation du taux de TeBG entraîne un
déséquilibre hormonal au profit de la fraction libre des
estrogènes et au détriment des androgènes libres (la
proportion de testostérone liée à la TeBG étant plus
importante). L’élévation de la TeBG, et le déséquilibre
hormonal qui en découle, est une cause classique de
gynécomastie (11, 12). Cette élévation de la TeBG est
bien décrite chez les patients atteints de cirrhose, mais
pas chez ceux qui présentent une simple stéatose hépa-
tique (13). Chez les sujets diabétiques de type 2 insulino-
résistants, obèses et dyslipidémiques, tableau souvent
associé à une stéatose hépatique, il est même décrit une
diminution de la TeBG associée à une diminution de la
testostérone totale, la testostéronémie libre restant nor-
male dans cette situation (14). Le diabète de type 1 peut
en revanche être associé à une élévation de la TeBG, la
production hépatique de ce peptide étant stimulée par
l’insulinopénie (15). Cependant, dans cette situation
encore, l’élévation concomitante de la testostéronémie
totale explique une stabilité de la testostéronémie libre
qui n’est pas différente chez les sujets diabétiques de
type 1 et les sujets sains (16). Dans notre observation, il
aurait été intéressant de disposer du dosage de testo-
stéronémie libre ou biodisponible afin de déterminer si
l’élévation de la TeBG était impliquée dans la survenue
de la gynécomastie.
En dehors de la problématique iatrogène et des rela-
tions complexes entre le diabète et la TeBG, une autre
étiologie de gynécomastie pourrait être évoquée pour
notre observation. En effet, des cas de véritable masto-
pathie diabétique ont été décrits, se caractérisant à
l’imagerie par un bourgeon mammaire d’échostruc-
ture très irrégulière (17). La mastopathie diabétique a
cependant été décrite chez des patients atteints d’un
diabète de type 2 mal équilibré et multicompliqué, ce
qui n’est pas le cas chez notre patient.
Bien qu’il soit impossible de le prouver avec certitude,
la séquence chronologique de cette observation sug-
gère que la gynécomastie de ce patient est imputable
au traitement par simvastatine, association qui n’avait
jusqu’alors jamais été décrite, à notre connaissance.
■
1
/
3
100%