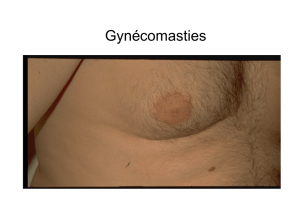
Gynécomasties

u
MISE AU POINT Progrès en Urologie (1999), 9, 1132-1135
1132
Gynécomasties
Jean-Louis PARIENTE, François JACOB, Colette DEMINIERE, Jean-Marie FERRIERE, Michel LE GUILLOU
Service d’Urologie-Andrologie et de Transplantation Rénale, Hôpital Pellegrin, Bordeaux, France
La pathologie mammaire chez l’homme est rare. Il est
cependant important de savoir distinguer les différentes
entités nosologiques. La gynécomastie est la manifes-
tation la plus fréquente.
DEFINITION
La gynécomastie correspond à une hyperplasie non
tumorale de la glande mammaire. Elle touche générale-
ment les deux seins, mais peut cependant être unilaté-
rale. Ceci peut paraître paradoxal, surtout lorsqu’une
étiologie endocrinienne doit être retenue, mais s’ex-
plique par des différences de sensibilité hormonale des
récepteurs présents au niveau du tissu mammaire [5,
20, 27].
ANATOMO-PATHOLOGIE
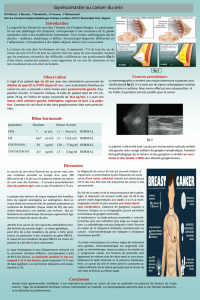
Il s’agit d’une prolifération galactophorique et
conjonctive de type oestrogénique, sans acini, mais
avec ébauche de pseudo-lobules (Figure 1). La propor-
tion entre tissu épithélial et tissu conjonctif dépend de
l’ancienneté de la gynécomastie.
Trois types anatomopathologiques sont décrits dans la
classification de WILLIAMS [25, 29] :
• Le type 1 correspond à un aspect floride, assez
typique de l’oestrogénothérapie. L’hyperplasie des
canaux est entourée de façon concentrique par un
conjonctif assez lâche et oedémateux où les fibres
collagènes sont rares. L’épithélium est hyperpla-
s i q u e .
• Le type 2 montre un aspect quiescent. C’est le type le
plus fréquent. Les canaux sont enchâssés dans un col-
lagène dense, sans hyperplasie épithéliale (Figure 1).
• Le type 3 montre un aspect dissocié. C’est le plus
rare. Il existe une hyperplasie épithéliale des canaux
mais le collagène est dense.
Travail du Comité d’Andrologie de l’AFU.
Manuscrit reçu : mai 1999, accepté : août 1999.
Adresse pour correspondance : Dr.J.L. Pariente, Service d’Urologie Andrologie
et Transplantation rénale, Hôpital Pellegrin-Le Tripode, Place Amélie Raba Léon,
33076 Bordeaux Cedex.
RESUME
La gynécomastie est la manifestation la moins rare de la pathologie mammaire
chez l’homme. C’est pourquoi l’urologue doit savoir distinguer les diff é rentes enti-
tés nosologiques, éliminer une tumeur testiculaire et re c o n n a î t r e les principales
étiologies en réalisant un bilan simple mais complet. Le traitement médical est
assez décevant. Le traitement chirurgical s’adresse aux patients présentant des
complicationss ou chez qui la persistance d’une gynécomastie est gênante sur le
plan esthétique.
Mots clés : Gynécomastie, androgènes, cancer du testicule, effets secondaires, médicaments.
Figure 1. Gynécomastie de type 2 : prolifération galactopho -
rique et conjonctive avec des pseudo-lobules entourés de
façon concentrique par un conjonctif assez dense (HES x 25).

1133
PHYSIOPATHOLOGIE
L’apparition d’une gynécomastie traduit une modifica-
tion du rapport oestrogène sur testostérone. En effet,
les androgènes, la testostérone ou la dihydrotestostéro-
ne sont inhibiteurs de la prolifération du tissu mam-
m a i r e . Les oestrogènes, exogènes ou provenant de
l’aromatisation des androgènes, stimulent la proliféra-
tion du tissu mammaire.
Il existe de nombreuses hormones régulatrices comme
les hormones thyroïdiennes, le cortisol, la prolactine,
les gonadotrophines hypophysaires, l’HCG, l’hormone
de croissance et l’insuline [28].
CLINIQUE
L'interrogatoire oriente le diagnostic. Il faut rechercher
des antécédents familiaux du même type, des manifes-
tations semblables à la puberté.
L'examen clinique précise le caractère uni ou bilatéral,
la symétrie éventuelle de la gynécomastie et le volume
de la tuméfaction, sa situation par rapport à la plaque
aréolaire (centrée ou non). La palpation recherche éga-
lement un écoulement mamelonnaire et d’éventuelles
adénopathies axillaires. L'examen clinique doit être
complet en étudiant les caractères sexuels secondaires
(pilosité, habitus, répartition des graisses), en exami-
nant en particulier les testicules à la recherche d'un
nodule suspect, la thyroïde, le foie et la peau (angiomes
stellaires, pigmentation anormale).
Les examens complémentaires peuvent être utiles : une
mammographie [9] et/ou une échographie mammaire
permettent de mieux préciser les caractères perçus lors
de l'examen clinique et de confirmer le diagnostic de
gynécomastie. La radiographie pulmonaire permet de
rechercher une tumeur bronchopulmonaire.
Sur le plan biologique, le bilan hormonal doit compor-
ter : FSH, LH, prolactinémie, œstradiol et testostérone
plasmatique, HCG et TeBG.
En fonction des résultats de ce bilan hormonal, un com-
plément plus orienté peut être demandé : une échogra-
phie testiculaire, un bilan thyroïdien, hépatique ou sur-
rénalien.
ETIOLOGIES
Il est difficile de définir avec précision la fréquence de
survenue d'une gynécomastie pour les différentes étio-
logies citées car il s'agit pour certaines de cas spora-
diques rapportés dans la littérature et pour d'autres de
manisfestations plus fréquentes qui correspondent en
fait à des effets secondaires indésirables.
•Les étiologies iatrogènes représentent la cause la
plus fréquente. La liste des médicaments responsables
d'une gynécomastie est longue :
- Les œstrogènes, utilisés par le patient dans le traite-
ment du cancer de prostate ou utilisés par sa partenaire
en gel per cutané, qui peut être absorbé lors d'un
contact direct peu de temps après utilisation de ce gel.
- Les androgènes par augmentation de la conversion
périphérique,
- les anti-androgènes (acétate de cyprotérone, flutami-
de, kétoconazole, spironolactone, cimétidine) ou cer-
tains toxiques pouvant avoir des propriétés anti-andro-
gènes (haschich, marijuana),
- les agonistes du GnRh,
- les inhibiteurs de la 5αréductase (finastéride) [7],
- les œstrogènomimétiques (digoxine, isoniazide),
- les anti-dopaminergiques (sulpiride, métoclopramide,
tiapride, phénothiazine, risperidone),
- la chimiothérapie anti-néoplasique [3],
- les inhibiteurs de l'urico-synthèse (allopurinol) [23],
- traitement anti HIV: antiprotéases (indinavir), et inhi-
biteurs de la reverse transcriptase (stavudine) [6, 21].
•Les étiologies gonadiques :
- Tumeurs à cellules de Leydig (hypersécrétion d'œs-
trogènes) [11, 22],
- tumeurs germinales (hypersécrétion d'HCG) [3],
- tumeurs à cellules de Sertoli (hyper aromatisation des
androgènes),
- hypogonadismes congénitaux ou acquis (syndrome de
Klinefelter, traumatisme, torsion, radiothérapie, chi-
miothérapie),
- pseudo hermaphrodisme (déficit enzymatique),
- syndrome de résistance aux androgènes.
•Les étiologies tumorales non génitales :
- surrénaliennes (hypersécrétion d'œstrogènes et/ou
d'androstenedione),
- bronchiques (épidermoïde),
- hépatiques (hépatoblastome),
- rénales, cérébrales,
- adénome à prolactine [13].
•Les étiologies métaboliques :
- alcoolisme et cirrhose (élévation de la TeBG et aug-
mentation de l'œstradiol libre et abaissement de la tes-
tostérone libre) [16, 18, 30],
- dénutrition sévère,
J.L. Pariente et coll., Progrès en Urologie (1999), 9, 1132-1135

- insuffisance rénale,
- hyperthyroïdie (élévation de la TeBG) [12].
•Les étiologies diverses :
- hyperstimulation du mamelon (sexuelle ou névro-
tique),
- idiopathiques.
EVOLUTION
L'évolution est variable selon l'étiologie.
Les gynécomasties peuvent quelquefois disparaître
spontanément, mais le plus souvent cela dépend de la
cause. Cependant, si le degré de fibrose est important
(surtout quand la gynécomastie est ancienne), la régres-
sion ne sera pas obtenue malgré la suppression de la
cause.
Les différentes complications connues en pathologie
mammaire chez la femme peuvent survenir, à savoir
des kystes, des fibro-adénomes ou une inflammation
locale. La dégénérescence est exceptionnelle sauf pour
le patient porteur d'un syndrome de Klinefelter.
TRAITEMENT
Le traitement médical est assez décevant. On peut uti-
liser, selon les étiologies une androgénothérapie per
cutanée, du tamoxifène, du danazol, ou de la bromo-
criptine [4, 14,16,17].
Chez les patients traités pour un cancer de la prostate
on peut tenter un changement d'anti-androgène sans en
attendre un résultat parfait. Certains auteurs ont même
pu proposer une radiothérapie localisée, préventive ce
qui paraît un peu lourd [14].
Le traitement chirurgical s'adresse aux patients présen-
tant des complications ou chez qui la persistance d'une
gynécomastie est gênante sur le plan esthétique. Ce
traitement chirurgical ne résoud pas le problème étiolo-
gique.
Sur le plan technique deux types d'interventions peu-
vent être proposés :
- Le plus classique est une mastectomie sous-cutanée
réalisée par une incision péri-aréolaire [8, 19, 24, 26].
Un excès de peau peut être corrigé par une bourse. Un
pansement compressif est nécessaire pendant
quelques jours. La complication la plus fréquente est
une invagination du mamelon. Si une incision péri-
aréolaire n'est pas réalisée la cicatrice peut être ines-
t h é t i q u e .
- Le second est représenté par des techniques d'aspira-
tion sur le modèle de la liposuccion [1, 2, 10] par micro
incision para-aréolaire ou par incision axillaire.
TROIS CAS PARTICULIERS
•La poussée mammaire néonatale : il s'agit d'une
manifestation assez fréquente, touchant près de deux
tiers des nourrissons. Elle survient plus précocement
chez le garçon que chez la fille. On identifie trois
stades : le stade I correspondant à une tuméfaction sous
aréolaire du mammelon, le stade II, cette tuméfaction
déborde l'aréole et un stade III où à la tuméfaction
s'ajoute un écoulement mamelonnaire. Cette poussée
mammaire néonatale est spontanément résolutive et ne
nécessite aucun traitement.
•La poussée mammaire pubertaire: cette manifesta-
tion est également très fréquente touchant près de la
moitié des garçons [15]. Elle survient aux alentours de
13-14 ans et on retrouve souvent une notion héréditai-
re. Il s'agit d'une tuméfaction bilatérale de petite taille,
sensible, voire douloureuse à la palpation. Elle peut
quelquefois se compliquer. La régression spontanée est
classique en un à deux ans. C'est la raison pour laquel-
le l'abstention thérapeutique est la règle. Cependant, en
cas de persistance d'une tuméfaction inesthétique, un
traitement chirurgical peut être proposé.
La gynécomastie du vieillard: c'est une manifestation
qui est assez rare. Il faudra distinguer cette manifesta-
tion d'une gynécomastie iatrogène liée aux traitements
médicaux. Il s'agit le plus souvent d'une gynécomastie
liée à un hypogonadisme.
CONCLUSION
L'augmentation du volume mammaire ne suffit pas
pour porter le diagnostic de gynécomastie. L'urologue
doit savoir prendre en charge ces patients et réaliser un
bilan étiologique précis pour proposer un traitement
adapté au contexte.
REFERENCES
1. ABRAMO A.C.: Axillary approach for gynecomastia liposuction .
Aesthetic. Plast. Surg., 1994, 18, 265-268.
2. ABRAMO A.C., VIOLA J.C. : Liposuction through an axillary inci-
sion for treatment of gynecomastia. Aesthetic. Plast. Surg., 1989, 13,
85-89.
3. AKI F.T., TEKIN M.I., OZEN H. : Gynecomastia as a complication
of chemotherapy for testicular germ cell tumors. Urology, 1996, 48,
944-946.
4. BOWERS S.P., PEARLMAN N.W., McINTYRE R.C. Jr., FINLAY-
SON C.A., HUERD S. : Cost-effective management of gynecomas-
tia. Am. J. Surg., 1998, 176, 638-641.
5. BRAUNSTEIN G.D. : Gynecomastia. N. Engl. J. Med., 1993, 328,
490-498.
6. CAEIRO J.P., VISNEGARWALA F., RODRIGUEZ-BARRADAS
M.C. : Gynecomastia associated with indinavir therapy. Clin. Infect.
Dis., 1998, 27, 1539-1540.
1134
J.L. Pariente et coll., Progrès en Urologie (1999), 9, 1132-1135

____________________
7. CARLIN B.I., SEFTEL A.D., RESNICK M.I., FINDLAY J. :
Finasteride induced gynecomastia. J. Urol., 1997, 158, 547.
8. CASANOVA D., MAGALON G. : Traitement chirugical des gynéco-
masties. J. Chir. (Paris), 1997, 134, 76-79.
9. CHANTRA P.K., SO G.J., WOLLMAN J.S., BASSETT L.W. :
Mammography of the male breast. A.J.R. Am. J. Roent. Genol.,
1995, 164, 853-858.
10. DOLSKY R.L. : Gynecomastia. Treatment by liposuction subcuta-
neous mastectomy. Dermatol. Clin., 1990, 8, 469-478.
11. GANA B.M., WINDSOR P.M., LANG S., McINTYRE J., BAXBY
K. : Leydig cell tumour. Br. J. Urol., 1995, 75, 676-678.
12. HO H.K., LOH K.C. : Hyperthyroidism with gynaecomastia as the
initial complaint: a case report. Ann. Acad. Med. Singapore, 1998,
27, 594-596.
13. KLEINBERG D.L., DAVIS J.M., De COSTER R., VAN BAELEN
B., BRECHER M. : Prolactin levels and adverse events in patients
treated with risperidone. J. Clin. Psychopharmacol., 1999, 19, 57-61.
14. LEMACK G.E., POPPAS D.P., VAUGHAN E.D. : Urologic causes
of gynecomastia: approach to diagnosis and management. Urology,
1995, 45, 313-319.
15. MAHONEY C.P. : Adolescent gynecomastia: differential diagnosis
and management. Pediatr. Clin. North Am., 1990, 37, 1389-1404.
16. MARTINEZ-RIERA A., SANTOLARIA-FERNANDEZ F., GON-
ZALEZ REIMERS E., MILENA A., GOMEZ-SIRVENT J.L.,
RODRIGUEZ-MORENO F., GONZALEZ-MARTIN I., ROFRI-
GUEZ-RODRIGUEZ E. : Alcoholic hypogonadism: hormonal res-
ponse to clomiphene. Alcohol, 1995, 12, 581-587.
17. MATHUR R., BRAUNSTEIN G.D. : Gynecomastia : pathomecha-
nisms and treatment strategies. Horm. Res., 1997, 48, 95-102.
18. MOTOO Y., TAGA H., SU S.B., SAWABU N. : Effect of gegen-tang
on painful gynecomastia in patients with lever cirrhosis: a brief
report. Am. J. Chin. Med. 1997, 25, 317-324.
19. PARK A.J., LAMBERTY B.G. : Gynaecomastia: have Webster's les-
sons been ignored? J.R. Coll. Surg. Edinb., 1998, 43, 89-92.
20. PONS J.Y. : Pathologie du sein masculin. in : Andrologie (tome 1),
G. Arvis, Paris,Maloine, 1987, 445-456.
21. SCHURMANN D., BERGMANN F., EHRENSTEIN T., PAD-
BERBG J. : Gynaecomastia in a male patient during protease inhibi-
tor treatment for acute HIV disease. AIDS 1998, 12, 12, 2232-2233.
22. SCIARRA A., CASALE P., Di NICOLA S., Di CHIRO C., Di SIL-
VERIO F.,: Hormonal profile of patients with Leydig cell tumors: a
urologic cause of gynecomastia. Minerva Urol. Nefrol., 1998, 50,
241-246.
23. SEIBEL V., MULLER H.H., KRAUSE W. : Incidence of gyneco-
mastia in dermatology patients. Hautarzt., 1998, 49, 382-387.
24. SMOOT E.C. : Eccentric skin resection and purse-string closure for
skin reduction with mastectomy for gynecomastia. Ann. Plast. Surg.,
1998, 41, 378-383.
25. TROJANI M. : Atlas d'histopathologie mammaire. Paris, Maloine,
1988, 104-105.
26. VASSEUR C., MARTINOT V., HODIN E., PATENOTRE P., PEL-
LERIN P. : Gynécomastie. Prise en charge diagnostique et thérapeu-
tique. Apropos of 52 cases. Ann. Chir., 1998, 52, 146-157.
27. WEBSTER D.J. : Benign disorders of the male breast. World J.
Surg., 1989, 13, 726-730.
28. WILLIAMS G.M. : Gynecomastia. N. Engl. J. Med. 1993, 15, 209.
29. WILLIAMS M.J. : Gynecomastia: its incidence, recognition and
host characterization in 447 autopsy cases. Am. J. Med., 1963, 34,
103-106.
30. YOSHITSUGU M., IHORI M. : Endocrine disturbances in liver cir-
rhosis focused on sex hormones. Nippon Rinsho, 1997, 55, 3002-
3006.
Commentaire d’Albert Leriche, Unité d’Urologie, Hôpital
Henry Gabrielle, Saint Genis Laval.
Cet article très intéressant expose de manière claire, synthétique
et concise une pathologie à laquelle tout urologue a été confron-
té un jour ou l’autre.Cet article représente une véritable mise au
point de la gynécomastie en citant de façon exhaustive les dif-
férentes étiologies et en donnant une conduite à tenir claire et
précise.
Outre l’examen clinique et le bilan biologique hormonal, l’écho-
graphie testiculaire doit bien évidemment être réalisée, d’après
nous, au moindre doute.
____________________
SUMMARY
Gynaecomastia : a review.
Gynaecomastia is the least rare manifestation of the male breast
disease. Urologists must therefore be able to distinguish the
various forms of gynaecomastia, eliminate a testicular tumour
and identify the main causes by performing a simple but com -
plete assessment. Medical treatment is fairly disappointing.
Surgical treatment is required in patients presenting with com -
plications or when persistent gynaecomastia is aesthetically
bothersome.
Key words : Gynaecomastia, androgens, testicular cancer,
adverse effects, drugs.
1135
J.L. Pariente et coll., Progrès en Urologie (1999), 9, 1132-1135
1
/
4
100%