Traitement conservateur de l’hyperplasie atypique D

ÉPIDÉMIOLOGIE
Le cancer de l’endomètre représente la quatrième cause de
cancer chez la femme, 97 % de ces cancers se développent à
partir de l’épithélium glandulaire (carcinome endométrial), et
les 3 % restants se développent à partir des cellules du tissu
conjonctif (sarcomes). Parmi les adénocarcinomes, on dis-
tingue deux sous-groupes de pronostic différent :
– les carcinomes à différenciation endométriale, hormono-
dépendants, de bon pronostic,
– les carcinomes à différenciation Müllerienne (carcinomes à
cellules claires, papillaires, anaplasiques) développés à partir
de foyers de métaplasie ectopique, de pronostic plus sévère.
Plus des deux tiers des cancers de l’endomètre surviennent en
post-ménopause. Les résultats du traitement conventionnel,
consistant en une hystérectomie avec annexectomie bilatérale
et curage pelvien en fonction de l’extension et du grade histo-
logique, sont favorables (tableau I). Sur une série de 923 hys-
térectomies effectuées pour pathologies bénignes, Weiderpass
et al. (1999) rapportaient 0,4 % de cancers endométriaux.
La survenue du cancer de l’endomètre chez des femmes de
moins de 40 ans n’est pas une circonstance rare puisqu’elle
représente 3 à 5 % des cas. Chez les femmes jeunes, ce cancer
pose le problème d’un traitement conservateur afin de préser-
ver le potentiel obstétrical.
HYPERPLASIES ATYPIQUES DE L’ENDOMÈTRE
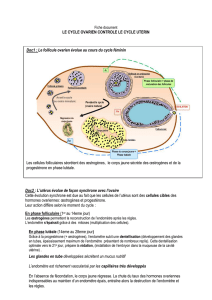
(figure)
La fréquence dans la population générale des hyperplasies et
notamment des hyperplasies atypiques (HA) de l’endomètre
n’est pas connue. Depuis les travaux de Cullen et Backer à la
fin du XIXesiècle, l’hyperplasie endométriale est considérée
comme un précurseur du cancer de l’endomètre. En fait, seules
les hyperplasies atypiques présentent un risque important
d’évolutivité vers un cancer invasif. Dans la série prospective
de Lindahl et al., comportant 246 patientes suivies pendant
5ans pour une hyperplasie simple, aucun cancer de l’endo-
mètre n’a été découvert, par contre 9 des 52 patientes por-
teuses d’une hyperplasie atypique ont développé un adénocar-
cinome (17 %).
Selon Kurman, la durée de progression d’une hyperplasie aty-
pique vers un cancer de l’endomètre est plus courte chez les
femmes de moins de 40 ans par rapport à celles âgées de plus
de 40 ans : en moyenne 3,3 ans et 7,8 ans, respectivement. Le
risque de progression d’une HA vers le cancer de l’endomètre
sous traitement progestatif est 10 fois plus faible comparé au
risque spontané d’évolution (2,7 % versus 27 %).
Les signes d’appel sont généralement discrets. Le diagnostic
peut être fait lors du bilan de métrorragies ou sur des biopsies
de l’endomètre dans le cadre du bilan d’une infertilité.
DOSSIER
36
La Lettre du Gynécologue - n° 266 - novembre 2001
* Service de gynécologie et obstétrique, hôpital Bichat-Claude-Bernard, 46, rue
Henri-Huchard, 75018 Paris.
** Service de gynécologie et obstétrique, hôpital Tenon, 4, rue de la Chine,
75020 Paris.
Traitement conservateur de l’hyperplasie atypique
et du cancer de l’endomètre au stade précoce
●A. Birsan*, R. Detchev**, E. Daraï**
Stade FIGO Fréquence (%) Survie (%)
I 81 83
II 11 73
III 6 52
IV 2 10
Tableau I. Pronostic du cancer de l’endomètre en fonction du stade
FIGO.
Figure. Aspect hystérroscopique d’une HA.

Les facteurs de risque des patientes porteuses d’une hyperpla-
sie atypique ou d’un cancer de l’endomètre sont communs
(tableaux II et III).
Soixante pour cent des HA peuvent régresser spontanément.
Toutefois, le problème est de savoir reconnaître les patientes
de mauvais pronostic soit du fait de l’absence de régression
spontanée soit de l’absence de réponse au traitement. Lindahl
et al. (1998) ne retrouvaient pas de corrélation entre la pré-
sence de récepteurs hormonaux aux estrogènes et à la proges-
térone et l’évolution des HA. De même, l’index pondéral, les
caractéristiques histologiques, les données de la cytométrie de
flux et l’expression de bcl-2 se sont révélés insuffisants.
Toutefois, dans l’étude de Amezcua et al. (1999), chez les
patientes traitées par progestatifs pour hyperplasie endomé-
triale avec ou sans atypies, l’expression de bcl-2 était diminuée
lorsque le traitement par progestatifs était efficace. L’expres-
sion de bcl-2 pourrait donc représenter un marqueur potentiel
de la réponse au traitement médical.
Dans l’état actuel de nos connaissances, rares sont les données
cliniques, biologiques ou histologiques permettant d’identifier
les hyperplasies atypiques de l’endomètre ayant un risque
élevé d’évoluer vers un véritable cancer.
CANCER DE L’ENDOMÈTRE AU STADE PRÉCOCE
Outre les facteurs de risque que nous avons évoqués pour les
hyperplasies atypiques de l’endomètre, les patientes jeunes à
risque de développer un cancer de l’endomètre sont le plus
souvent nullipares, obèses et présentent des cycles anovula-
toires (Ron et al., 1987). Parmi ces patientes, 60-70 % sont
porteuses d’un syndrome de Stein-Leventhal.
Le diagnostic clinique ne présente pas de particularité et
repose sur le bilan étiologique de méno-métrorragies. La légiti-
mité du traitement conservateur chez les patientes ayant un
carcinome endométrial repose sur l’identification de facteurs
de bon pronostic : un stade précoce, l’absence d’envahisse-
ment ganglionnaire et un grade histologique faible.
L’absence d’invasion myométriale est au mieux appréciée par
l’IRM avec injection de gadolinium (Kinkel et al., 1999). Le
risque de métastase ganglionnaire est dépendant à la fois du
stade et du grade histologique. L’invasion ganglionnaire varie
selon les auteurs de 0 à 3 % dans les stades I grade 1. Il avoi-
sine les 9 à 10 % pour les carcinomes de grades 2 et 3, ou
lorsque l’invasion myométriale dépasse le tiers interne.
Christopherson (1982) a démontré que le pronostic diffère éga-
lement en fonction du type histologique de tumeur avec deux
sous-types particulièrement agressifs : les carcinomes à cel-
lules claires (6 % des cas) ayant une survie à 5 ans de 44 %, et
les carcinomes papillaires séreux (5 %) dont la survie à 5 ans
est estimée entre 36 et 40 %.
Evans et al. rapportaient chez les femmes de moins de 45 ans
une association d’un carcinome endométrial à un carcinome
ovarien dans 11 % des cas alors que cette association n’était
retrouvée que dans 2 % des cas au-delà de cet âge.
Outre les facteurs histo-pronostiques classiques, la biologie
permet d’identifier de nouveaux marqueurs de pronostic. Les
analyses multivariées soulignent la valeur péjorative de la sur-
expression de la P53. De plus, ce facteur de pronostic semble
indépendant (Powell et al., 1999) et est fortement corrélée
avec les sous-types histologiques agressifs, le stade avancé et
l’invasion vasculo-lymphatique (Ozsaran et al., 1999). Selon
Athanassiadou et al. (1999), les patientes ayant un stade pré-
coce de cancer de l’endomètre mais avec une sur-expression
de la P53 doivent être considérées à haut risque.
Au total, devant un cancer de l’endomètre, les facteurs de pro-
nostic autorisant une prise en charge conservatrice, sont :
– les tumeurs de stade I, grade 1
– l’absence d’invasion myométriale à l’IRM,
– l’absence d’invasion ganglionnaire,
– la présence de récepteurs hormonaux RE, RP
– le type histologique : carcinome à différenciation endomé-
triale
– le caractère diploïde de la tumeur, avec un index de prolifé-
ration bas
– l’absence de sur-expression du gène P53
– l’expression de bcl-2.
MODALITÉS DU TRAITEMENT CONSERVATEUR
Divers traitements médicaux ont été proposés pour les hyper-
plasies atypiques et les cancers de l’endomètre. Les progesta-
tifs sont utilisés depuis les années 60 dans le traitement des
hyperplasies endométriales, sans qu’il existe, à l’heure
actuelle, un consensus concernant le type de molécule et la
durée du traitement.
Les travaux de Kelley et Baker avaient rapporté l’efficacité,
dans le cancer de l’endomètre, du traitement par progestatif
par un effet anti-prolifératif et par une diminution de l’activité
mitotique. Les progestatifs ont un effet anti-estrogénique par la
diminution du nombre de RE et la stimulation de la conversion
de l’estradiol en estrone.
37
La Lettre du Gynécologue - n° 266 - novembre 2001
Hyperplasie atypique Adénocarcinome
(n = 27) bien différencié (n = 29)
Âge 34,3 (25-39) 30,5 (18-39)
Obésité (> 85 kg) 17 (63 %) 18 (62 %)
Nulliparité 24 (89 %) 22 (76 %)
Anomalies du cycle 18 (67 %) 19 (66 %)
Infertilité 12 (44 %) 15 (52%)
Tableau III. Comparaison des caractéristiques cliniques des patientes
présentant une hyperplasie atypique ou un cancer de l’endomètre
(selon Randall et al., 1997).
Facteurs de risque Risque relatif (RR)
Surcharge pondérale :
9-23 kg 3
> 23 kg 10
Nulliparité 2
Diabète 2,7
Tableau II. Facteurs de risque et risque relatif du cancer de l’endo-
mètre.

Les dérivés 19-norstéroïdes ont été largement utilisés dans le
traitement des hyperplasies endométriales, notamment dans les
formes simples. Le progestatif le plus fréquemment préconisé
est l’acétate de médroxyprogestérone. Cependant, il présente
de nombreux effets secondaires dont une augmentation de la
concentration plasmatique de l’insuline, une modification du
lipidogramme, une activité anti-aldostérone, un effet direct sur
le tonus de la paroi artérielle (probablement par le biais de la
production des prostaglandines) et un effet antagoniste de la
NO-synthétase. De plus, l’utilisation prolongée de ce type de
progestatif expose à un risque thrombo-embolique. Sur le plan
clinique, la tolérance est parfois médiocre, avec des céphalées,
des nausées et une sécheresse vaginale. D’autres progestatifs
sont fréquemment utilisés dans la littérature dont l’acétate de
mégestrol et la 17alpha-progestérone.
Le tamoxifène et le danazol ont également été préconisés. Le
tamoxifène conduit à l’augmentation du nombre des récepteurs
à la progestérone, ce qui a incité à l’association du tamoxifène
avec les progestatifs (Randall et al., 1997 ; Kung et al., 1997).
Les analogues du GnRH ont été proposés depuis 1992 du fait
de leur action inhibitrice in vitro sur la croissance de lignées
cellulaires de cancer de l’endomètre (Kullander et al., 1992 ;
Levy et al., 1993) et l’expression de récepteurs au GnRH par
les cellules de cancer de l’endomètre (Emons, 1994). Enfin,
l’efficacité des analogues du GnRH a été prouvée chez des
patientes présentant une récidive de cancer et résistant aux
progestatifs (Gallagher et al., 1991; De Vriese et Bonte,
1993). Les antagoniste du GnRH (triptoreline et cétrorelix) ont
une action anti-proliférative directe in vitro sur les lignées de
cancer de l’endomètre. Peu de données sont actuellement dis-
ponibles sur leur efficacité dans le traitement des hyperplasies
atypiques et le cancer de l’endomètre.
MODALITÉS PRATIQUES DU TRAITEMENT MÉDICAL
DES HYPERPLASIES ATYPIQUES ET DU CANCER
DE L’ENDOMÈTRE
Le traitement médical des hyperplasies atypiques et du cancer
de l’endomètre au stade précoce ne peut être envisagé que
pour des patientes désirant conserver leur potentiel obstétrical.
Il est clair que tous les arguments de bon pronostic des hyper-
plasies atypiques et du cancer de l’endomètre doivent être
réunis. La décision de ce traitement ne peut être prise qu’après
avoir informé la patiente des risques et des limites de ce traite-
ment et avoir obtenu leur consentement éclairé. Le risque de
non-réponse au traitement doit être souligné et faire envisager
une thérapeutique chirurgicale non conservatrice.
Les modalités pratiques comportent une exploration première
de la cavité utérine par une hystéroscopie et un curetage endo-
métrial qui doit intéresser l’intégralité de l’endomètre. Ce pre-
mier temps est suivi d’un traitement qui, pour notre part, com-
porte soit des progestatifs en continu soit des analogues du
GnRH pour une durée d’au moins 3 mois. Un nouveau
contrôle par hystéroscopie est réalisé et comporte systémati-
quement un prélèvement pour un examen histologique. La per-
sistance d’une muqueuse floride à l’hystéroscopie doit
conduire à un nouveau curetage. Selon les résultats anatomo-
pathologiques, la stratégie thérapeutique est définie. Dans le
cas d’une réponse favorable, du fait de la fréquence élevée
d’une infertilité d’origine ovulatoire chez ces patientes, se
pose le problème de l’indication d’une stimulation voire du
recours à une fécondation in vitro. Dans le cas d’une réponse
incomplète, le traitement doit être poursuivi pendant quelques
mois avec un nouveau contrôle hystéroscopique et histolo-
gique. Selon les auteurs, l’absence de réponse après 9 mois ou
12 mois de traitement nécessite une prise en charge chirurgi-
cale.
RÉSULTATS DU TRAITEMENT CONSERVATEUR
Dans la série de Randall (tableau IV), aucune des patientes
traitées pour HA par progestatifs (acétate de mégestrol à la
dose comprise entre 40 et 160 mg/jour) n’a développé d’adé-
nocarcinome. La majorité des patientes (94 %) ont eu une
régression totale de la maladie après un traitement d’une durée
variant entre 3 et 12 mois.
Parmi les patientes ayant un cancer de l’endomètre, 75 % ont
eu une régression complète. Les doses d’acétate de mégestrol
utilisées étaient plus importantes, de 80-400 mg/jour. Le recul
de l’étude était de 40 mois en moyenne.
Dans la série de Perez-Medina (1999), les patientes avaient un
traitement associant les analogues du GnRH et des progesta-
tifs. Cette association ne semblait pas plus efficace que les
progestatifs seuls.
Il n’existe pas de consensus sur les modalités du traitement
médical. En effet, selon les auteurs, les doses préconisées
d’acétate de médroxyprogestérone et de mégestrol varient de
10 à 160 mg/jour. De même, il n’existe pas de consensus sur
l’utilisation séquentielle ou continue des progestatifs. Enfin, la
durée du traitement oscille entre 3 et 24 mois (Ferenczy et al.,
1989 ; Gal et al., 1986 ; Wentz et al., 1985).
D’autres voies d’administration des progestatifs ont été égale-
ment proposées telles que la voie intra-utérine pour le lévonor-
gestrel ou des crèmes vaginales à la progestérone (Affinito et
al., 1994). Les résultats de ces divers traitements sont encoura-
geants pour les hyperplasies simples (86 à 91% de succès),
mais médiocres pour les hyperplasies atypiques (moins de
50 %).
Peu de données sont actuellement disponibles sur l’utilisation
des analogues du GnRH et ne concernent que les hyperplasies
de l’endomètre (tableau V).
DOSSIER
38
La Lettre du Gynécologue - n° 266 - novembre 2001
nRégression Persistance Progression Récurrence
Hyperplasie atypique
Perez-Medina, 1999 19 16 (84 %) 1 (5 %) 1 (5 %) 1 (5 %)
Randall, 1997 17 16 (94 %) 1 (6 %) 0 0
Total 36 32 (89 %) 2 (5 %) 1 (2,7 %) 1 (2,7 %)
Cancer de l’endomètre
Randall, 1997 12 9 (75 %) 3 (25 %) 0 0
Sardi, 1998 43 (75 %) 1 (25 %) 0 0
Total 16 12 (75 %) 4 (25 %) 0 0
Tableau IV. Évolution des hyperplasies atypiques et des cancers de
l’endomètre traités par des progestatifs.

CONCLUSION
Le traitement chirurgical radical d’une HA ou d’un cancer de
l’endomètre de stade I constitue une solution lourde lorsqu’elle
s’adresse à des patientes jeunes désirant préserver leur fertilité.
Sous réserve d’une sélection rigoureuse des patientes, un trai-
tement médical conservateur peut être proposé. Toutefois,
cette attitude réclame alors implicitement la prise en charge
médicale de l’infertilité fréquemment associée, et pose le pro-
blème des effets délétères des stimulations ovariennes sur la
pathologie endométriale. À ce jour, il n’existe pas de consen-
sus, tant sur les modalités thérapeutiques que sur l’attitude à
avoir vis-à-vis de l’utérus après obtention d’une grossesse. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Dijkhuizen FP, Mol BW, Brolmann HA, Heintz AP. The accuracy of endome-
trial sampling in the diagnosis of patientes with endometrial carcinoma and
hyperplasia : a meta-analysis. Cancer 2000 ; 89 (8) : 1765-72.
2. Lawton F. The management of endometrial cancer. British Journal of
Obstetrics and Gynecology, February 1997 ; 104 : 127-34.
3. Lindahl B, Willen R. Steroid receptor Concentrations as a Prognostic Factor
in Atypical Endometrial Hyperplasia. Anticancer Research 1998 ; 18 : 3973-6.
4. Enomoto T, Fujita M, Inoue M. Alterations of the p53 tumour suppressor
gene and its association with activation of c-k-ras-2 protooncogene in premali-
gnant and malignant lesions of the human uterine endometrium. Cancer Res
1993 ; 53 : 1883-8.
5. Perez-Medina T, Bajo J, Folgueira G, Haya J, Ortega P. Atypical
Endometrial Hyperplasia Treatement with Progestogens and Gonadotropin-
Releasing Hormone Analogues: Long-Term Follow-up. Gynecologic Oncology
1999 ; 73 : 299-304.
6. Randall T, Kurman R. Progestin Treatment of Atypical Hyperplasia and
Well-Differentiated Carcinoma of the Endometrium in Women Under Age 40.
Obstet Gynecol 1997 ; 90 (3) : 434-40.
7. Sardi J, Anchezar H, Paniceres G, Gomez Rueda N, Vighi S. Primary hormo-
nal treatement for early endometrial carcinoma. Eur J Gynaecol Oncol 1998 ;
6: 565-8.
8. Agorastos T, Bontis J, Vakiani A, Vavilis D, Constantinidis T. Treatement of
Endometrial Hypeplasias with Gonadotropin-Release Hormone Agonists :
Pathological, Clinical, Morphometric and DNA-Cytometric Data, Gynecologic
Oncology 1997 ; 65 : 102-14.
9. Kurman RJ, Kaminski PF, Norris HJ. The behavior of endométrial hyperpla-
sie: a long terme study of “untreated” hyperplasia in 170 patientes. Cancer
1985 ; 56 : 403-12.
10. Amezcua CA, Zhengw, Muderspach L, Felix J. Down-Regulation of bcl-2 Is
a Potential Marker of the Efficacy of Progestin Therapy in the Treatement of
Endometrial Hyperplasia. Gynecologic Oncology 1999 ; 73 : 126-36.
11. Kim YB, Holschneider C, Ghost K, Nieberg R, Montzf. Progestin alone as
primary treatement of endométrial carcinoma in premenopausal women.
Cancer 1997 ; 79 : 320-5.
12. Kimming R, Strowitzki T, Muller-Hocker J, Kurzl R, Korrel M, Hepp H.
Conservative tratement of endométrial cancer permitting subsequent triplet pre-
gnancy. Gynecol Oncol 1995 ; 58 : 255-60.
13. Evans-Metcalf ER, Brooks SE, Reale FR, Baker S. Profile of women
45 years of age and younger with endométrial cancer. Obstet Gynecol 1998 ; 91
(3) : 349-53.
14. Gitsch G, Hanzal E, Hacker NF. Endometrial cancer in premenopausal
women 45 years and younger. Obstet Gynecol 1995 ; 85 : 504-8.
15. Emons G, Heyl W. Hormonal treatement of endometrial cancer. J Cancer
Res Clin Oncol 2000 ; 126 (11) : 619-23.
16. Chhieng DC, Ross JS, Ambros RA. bcl-2 expression and the development of
endometrial carcinoma. Mod Pathol 1996 ; 9 (4) : 402-6.
17. Taskin M, Lallas TA, Barbar HR, Schevchuk MM. bcl-2 and p53 in endo-
metrial carcinoma. Mod Pathol 1997 ; 10 (7) : 728-34.
18. Athanassiadou P, Petrakakou E, Liossi A, Nakopoulou L, Zerva C,
Dimopoulos A, Athanassiades P. Prognostic significance of p53, bcl-2 and
EGFR in carcinoma of the endometrium. Acta Cytol 1999 ; 43 (6) : 1039-44.
19. Evans MP, Podratz KC. Endometrial neoplasia: prognostic significance of
ploidy status. Clin Obstet Gynecol 1996 ; 39 (3) : 696-706.
20. Rose PG. Endometrial Carcinoma. N Eng J Med 1996 ; 9 (335) : 640-9.
21. Grimbizis G, Tsalikis T, Tzioufa V, Kasapis M, Mantalenakis S. Regression
of endometrial hyperplasia after treatment with the gonadotrophin-releasing
hormone analogue triptorelin : a prospective study. Hum Reprod 1999 ; (14) 2 :
479-84.
39
La Lettre du Gynécologue - n° 266 - novembre 2001
nRégression Persistance Progression
Hyperplasie simple 39 32 (86,5%) 7 (14,5%)
Hyperplasie complexe 14 12 (85,7%) 1 (7%) 1 (7%)
Hyperplasie atypique 30 3 0
Total 56
Tableau V. Évolution des hyperplasies endométriales après 6 mois de
traitement par triptoréline (Grimbizis et al.,1999).
1
/
4
100%