Perturbations endocriniennes associées aux néoplasies

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume IV, n° 2, avril 2000
55
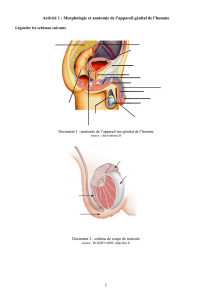
a gonade mâle adulte est composée de
deux grands contingents cellulaires :
les cellules germinales, d’une part, les cel-
lules du stroma spécialisé, d’autre part. Ces
dernières peuvent être situées à l'intérieur
des tubes séminifères (cellules de Sertoli)
ou, au contraire, dans l'interstitium (cel-
lules de Leydig). Chacun de ces types cel-
lulaires est capable de libérer des sécrétions
endocrines dans la circulation générale,
ainsi que des sécrétions paracrines à action
intratesticulaire. Les cellules de Leydig ont
essentiellement un rôle stéroïdogénique.
Les cellules de Sertoli sont la source de
nombreux facteurs protéiques, groupe dans
lequel s'inscrivent les différentes hormones
de la famille des activines-inhibines.
Bien que ne représentant que 2 % de l'en-
semble des carcinomes de l'homme (1),les
tumeurs testiculaires sont les plus fré-
quentes chez les sujets de 15 à 35 ans (2).
Les tumeurs développées à partir des cel-
lules stromales gardent le plus souvent la
capacité endocrine de la cellule originelle.
Elles s'expriment alors fréquemment par
une symptomatologie clinique et biolo-
gique endocrinienne. A contrario, neuf
tumeurs testiculaires sur dix, développées à
partir des cellules germinales, sont silen-
cieuses sur le plan endocrinien, l'activité
sécrétoire physiologique se limitant à l'éla-
boration de sécrétions paracrines (3).
Néanmoins, il faut garder présent à l'esprit
qu'environ 20 % des tumeurs séminoma-
teuses s'accompagnent d'une sécrétion
anormale d’hCG (4). Ce type de sécrétion
est observé dans la quasi-totalité des cas
de choriocarcinome, tumeur germinale
non séminomateuse qui a pour origine des
cellules du trophoblaste primitif. Glo-
balement, le taux d'hCG est élevé dans
70 % des tumeurs germinales non sémino-
mateuses (5).
La cellule de Leydig adulte synthétise de la
testostérone à partir du cholestérol en
empruntant préférentiellement, chez l’hom-
me, la voie ∆5 de la stéroïdogenèse. La
voie ∆4, conduisant de la progestérone à la
testostérone via la formation de ∆4 andros-
tènedione, quoique minoritaire, existe
néanmoins dans la cellule de Leydig
humaine adulte. La testostérone synthétisée
est majoritairement libérée dans la circu-
lation. Une part minime est soit réduite en
5-α-dihydrotestostérone (DHT), soit trans-
formée en 17-β-estradiol (E2) par l'aroma-
tase testiculaire, avant d'être sécrétée. La
mesure des taux plasmatiques de ces deux
derniers stéroïdes ne reflète cependant pas
l'activité testiculaire réelle. À titre
d'exemple, 85 % du 17-β-estradiol formé
par aromatisation de testostérone a une ori-
gine extra-gonadique.
La synthèse et la sécrétion des stéroïdes
sexuels gonadiques sont sous le contrôle de
la cellule gonadotrope hypophysaire. La
sécrétion des gonadotrophines est elle-
même sous l'influence des stéroïdes gona-
diques (androgènes et estrogènes) et de
Perturbations endocriniennes
associées aux néoplasies
testiculaires
J.M. Kuhn*, H. Lefebvre*
* Service d'endocrinologie et maladies métaboliques, CHU, et unité INSERM 413, université de
Rouen.
✎ Les néoplasies testiculaires pri-
mitives peuvent exprimer un poten-
tiel sécrétoire emprunté aux cel-
lules dont elles dérivent
✎ Cette sécrétion hormonale peut
être responsable de manifestations
cliniques précédant parfois de plu-
sieurs années l’émergence clinique
de la tumeur.
✎ La sécrétion tumorale engendre
des profils hormonaux particuliers
à forte valeur diagnostique et pro-
nostique.
✎ En l’absence de tumeur testicu-
laire décelable cliniquement,
l’identification d’un profil hormo-
nal évocateur doit faire pratiquer
une enquête étiologique soigneuse
✎ Chez l’enfant, le tableau cli-
nique endocrinien est, en règle
générale, dominé par des signes
de masculinisation.
✎ À la diversité des profils hor-
monaux s’associe une variété de
tumeurs dont les caractères histolo-
giques se répartissent de la béni-
gnité totale aux caractères malins
les plus francs.
L

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume IV, n° 2, avril 2000
56
Mise au point
neurotransmetteurs excitateurs ou inhibi-
teurs. Ces influences modulatrices ont pour
résultante une sécrétion intermittente de
GnRH hypothalamique, qui est libérée
dans la circulation porte hypothalamo-
hypophysaire selon un mode pulsatile. Le
rétrocontrôle exercé sur la sécrétion de
GnRH est principalement assuré au niveau
de l'hypothalamus par la testostérone et ses
métabolites actifs, en particulier par le
biais de l'activation d'un système opioïder-
gique hypothalamique inhibiteur. L’estra-
diol est capable d'exercer une action à deux
niveaux : hypothalamique sur la sécrétion
de GnRH, et hypophysaire sur la sécrétion
de FSH qu'elle déprime. Cette dernière
sécrétion est également modulée par de
nombreux peptides hormonaux issus des
cellules de Sertoli. L'inhibine, synthétisée
conjointement par les cellules de Sertoli et
les gamètes, dont la sécrétion est stimulée
par la FSH, exerce en retour un rétrocon-
trôle négatif de la sécrétion de cette gona-
dotrophine par action hypophysaire préfé-
rentielle.
Le retentissement endocrinien des néopla-
sies testiculaires est le reflet de leur action
paracrine intratesticulaire et de leur interfé-
rence avec l’axe gonadotrope.
On peut schématiquement classer les sécré-
tions des néoplasies testiculaires respon-
sables d'effets endocriniens en cinq catégo-
ries : estrogènes, androgènes, sécrétions
mixtes d’estrogènes et d’androgènes, pep-
tides impliqués dans la régulation de la
sécrétion gonadotrope et, enfin, sécrétions
hormonales ectopiques.
Hypersécrétion d'estrogènes
Symptomatologie
C'est l'apparition de signes de féminisation
qui devra faire évoquer cette possibilité.
Ceux-ci incluent une gynécomastie (uni-
ou, plus souvent, bilatérale) souvent évolu-
tive. Elle s'accompagne fréquemment d'un
élargissement des aréoles mamelonnaires,
qui sont hyperpigmentées. Dans un tel
contexte, la recherche d'une galactorrhée
est négative. L'association à une diminution
de la libido et/ou une impuissance est à
rechercher de principe. La palpation testi-
culaire, geste clinique essentiel, permettra
de retrouver une asymétrie testiculaire ou
de détecter une tuméfaction unilatérale,
dont la présence pourra être confirmée par
une échographie. Le constat d'un profil
hormonal associant inflation absolue ou
relative de l’estradiolémie et diminution des
taux de base des gonadotrophines (tout
particulièrement de la FSH) amènera à
poursuivre les investigations. Une réduction
de l'ascension des gonadotrophines à l'ad-
ministration de 100 µg intraveineux de
GnRH (3), particulièrement nette pour la
FSH (6), contrastant avec une réponse quasi
normale de la LH (6, 7),est très évocatrice
d'une tumeur estrogénosécrétrice. La testo-
stéronémie est alors d'autant plus abaissée
que l'estradiolémie est élevée (8). Le rap-
port testostéronémie/estradiolémie est infé-
rieur à la normale (6, 9, 10), ce qui traduit
l'élévation relative du taux d'estradiol plas-
matique et son effet frénateur sur la sécré-
tion gonadotrope. Assez curieusement (car
les estrogènes en stimulent la synthèse), le
taux de Testosterone-estradiol Binding
Globulin (TeBG) est le plus souvent nor-
mal. Dans un tel contexte, la normalité du
taux de TeBG et l'indétectabilité de l'hCG
plasmatique devront, en l'absence de toute
prise médicamenteuse, faire évoquer le dia-
gnostic de tumeur testiculaire estrogénosé-
crétrice à cellules de Leydig. Cette situation
classique, où les données cliniques, écho-
graphiques et hormonales sont cohérentes,
souffre de nombreuses exceptions. Par
exemple, une tumeur à cellules de Leydig
peut donner des signes endocriniens impor-
tants, alors que le volume tumoral est réduit
et ne permet pas l'identification clinique de
la tumeur. Des signes de féminisation peu-
vent en effet précéder de plusieurs années
l'extériorisation clinique de la tumeur (6, 9,
11). C'est dans ces cas difficiles que deux
examens complémentaires peuvent être
d'une aide précieuse.
L’ascension exagérée (> 80 pg/ml, soit
290 pmol/l) du taux d’estradiol plasma-
tique trois jours après l'administration
intramusculaire de 5 000 unités d'hCG est
très fortement évocatrice du diagnostic de
tumeur à cellules de Leydig (3, 6, 7, 11),
bien que ce profil ne soit pas spécifique.
L'échographie testiculaire permet de détec-
ter, sous la forme d'une image arrondie
hypoéchogène par rapport au parenchyme
testiculaire normal, des tumeurs de petite
taille ou dont la localisation, au centre de la
glande, ne les rend pas accessibles à la pal-
pation (6, 12, 13). En l’absence d’image
échographique, l’enquête étiologique doit
être répétée quelques mois plus tard et per-
met très souvent d’aboutir au diagnostic.
La modestie ou l'intermittence de la
sécrétion tumorale peuvent être respon-
sables d'incertitude diagnostique. Un
tel constat, en présence de signes de
féminisation, doit faire redoubler de
vigilance. Les symptômes de fémi-
nisation peuvent, répétons-le, exister
longtemps avant l'identification de la
tumeur responsable. Il faudra donc
savoir renouveler les investigations si le
diagnostic n'est pas posé après la réalisa-
tion d'une première batterie de tests (14).
Cadres pathologiques
Un tel tableau est très évocateur des
tumeurs à cellules de Leydig. Elles n’en
ont cependant pas l’apanage. Un tableau
similaire peut en effet s'observer au cours
des rares tumeurs à cellules de Sertoli. Les
cellules de Sertoli de l'homme adulte nor-
mal apparaissent capables d'aromatiser la
testostérone en 17-β-estradiol in vitro (15).
Une hyperexpression du gène de l’aroma-
tase a été démontrée dans une sous-variété
de tumeurs à cellules de Sertoli (16).
L’association de ce type de tumeurs à un
syndrome de Peutz-Geghers a été signalée
dans quelques cas (17),particularité parta-
gée avec un autre sous-type de tumeurs à
cellules de Sertoli : la forme calcifiante à
grandes cellules (18, 19). Survenant avant

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume IV, n° 2, avril 2000 57
30 ans, ces tumeurs peuvent s’associer à de
multiples anomalies endocriniennes in-
cluant féminisation, hypercortisolisme,
voire acromégalie (20). En outre, elles peu-
vent s’inscrire dans le cadre du syndrome
de Carney (21).
Mécanismes
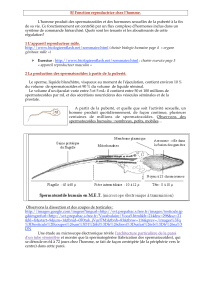
physiopathologiques (figure 1)
La sécrétion tumorale d’estradiol est liée à
une aromatisation excessive de la testosté-
rone. En effet, le blocage de l’activité aro-
matasique de tumeurs à cellules de Leydig
de l’adulte, féminisantes, étudiées in vitro,
montre que la testostérone est bien le pré-
curseur immédiat de la synthèse d’estradiol
par le tissu tumoral. L’inhibition spécifique
de l’aromatase tumorale a pour résultante
un effondrement de la sécrétion d’estradiol,
alors que celle de testostérone augmente de
façon considérable (22). Les cellules tumo-
rales surexpriment le gène codant pour
l’aromatase, dont la présence a été démon-
trée par immunohistochimie (23) et par
Northen-Blot (16, 24) au sein des cellules
de Leydig humaines normales.
L’inflation de la production de 17-β-estra-
diol retentit sur les fonctions testiculaires
exocrines et endocrines du tissu testi-
culaire normal, paratumoral et contro-
latéral. Une réduction de la spermatoge-
nèse a pu être identifiée dans certains cas.
L’accroissement de la concentration
intratesticulaire de 17-β-estradiol a été
rendue responsable d’une réduction de
l’activité de la 17-α−hydroxylase et de la
17-20 desmolase (3, 25). L’hyperestro-
génie, relative ou absolue, induit la fémi-
nisation observable cliniquement. Elle a
également pour conséquence des modifi-
cations sensibles de la sécrétion gonado-
trope. Si la fréquence des pulses sponta-
nés de LH n’apparaît pas modifiée par
l’hyperestradiolémie endogène, l’ampli-
tude des pics de LH apparaît d’autant plus
réduite que le taux d’estradiol est plus
élevé, traduction de son action inhibitrice
sur la sécrétion antéhypophysaire (8). La
chute du taux de testostérone est directe-
ment liée à l’inhibition exercée par la
sécrétion tumorale d’estradiol sur la
sécrétion de LH. Cependant, l’hyperestra-
diolémie n’est pas le seul facteur respon-
sable de la dépression de la sécrétion
gonadotrope. En effet, les tumeurs à cel-
lules de Leydig paraissent capables de
sécréter de l’inhibine B (8). La sécrétion
combinée d’estradiol et d’inhibine réduit
la sécrétion de FSH, dont la chute est en
général plus prononcée que celle de LH.
Le profil hormonal classique des tumeurs
à cellules de Leydig estrogénosécrétrices
de l’adulte s’explique donc par une
réduction de la sécrétion antéhypophy-
saire de LH avec, pour conséquence, une
chute de la sécrétion de testostérone et
une inhibition de la sécrétion de FSH par
action hypophysaire, sans altération de la
sécrétion de GnRH. Ce dernier fait
explique très vraisemblablement que la
réponse de la LH à l’injection aiguë de
GnRH soit comparable à celle de l’hom-
me adulte normal, alors que l’amplitude
de la réponse de la FSH est réduite.
Hypersécrétion de testostérone
Symptomatologie
Cette situation est plus rare et n’est habi-
tuellement individualisée que chez l’enfant
prépubère. En effet, le tableau clinique réa-
lise celui d’une pseudo-puberté précoce
associant virilisation, accélération de la
croissance et de la maturation osseuse.
Cette symptomatologie est la traduction
d’une inflation du taux de testostérone
plasmatique qui peut atteindre des valeurs
s’inscrivant dans la fourchette normale de
Figure 1. Conséquences d’une hypersécrétion tumorale de 17-
β
-estradiol.
OP : neurones opioïdergiques ; NT : neurotransmetteur.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume IV, n° 2, avril 2000
58
Mise au point
l’adulte. Contrastant avec ce chiffre, il est
impossible de détecter la présence de
gonadotrophines circulantes à l’état basal
ou même après stimulation par la GnRH.
La palpation testiculaire, geste essentiel,
peut mettre en évidence une tumeur unila-
térale ou une asymétrie gonadique, qui a la
même signification. L’échographie testicu-
laire est l’examen clé du diagnostic étiolo-
gique. Les tumeurs responsables sont des
tumeurs à cellules de Leydig qui, contraire-
ment à celles de l’adulte, sont androgéno-
sécrétrices ou, beaucoup plus rarement, des
tumeurs à cellules de Sertoli.
Mécanismes
physiopathologiques
Le profil hormonal observé s’explique par
l’autonomisation de la sécrétion de testo-
stérone par les cellules tumorales. En outre,
celles-ci exerceraient une rétroaction néga-
tive sur la sécrétion hypothalamique de
GnRH si elle s’était mise en route, ce qui
n’est pas le cas chez l’enfant prépubère.
La physiopathologie présidant à l’émer-
gence de la tumeur n’est sans doute pas
univoque. Des avancées ont néanmoins
été récemment effectuées. En effet, une
mutation activatrice du récepteur de la LH
a été mise en évidence chez trois garçons
prépubères atteints de tumeur masculini-
sante à cellules de Leydig. Il s’agit d’une
mutation Asp58His, responsable à la fois
d’une hyperplasie leydigienne et d’une
activation anormale de la stéroïdogenèse
testiculaire, aboutissant à la production de
testostérone (26). En aval du récepteur,
l’activation spontanée de la protéine
Gs-α,stimulatrice de l’adénylyl-cyclase
membranaire, a également été mise en
évidence dans certaines pseudo-pubertés
précoces masculines entrant notamment
dans le cadre du syndrome de McCune
Albright (27). À l’inverse, ce type de
mutation activatrice de la protéine Gs-α
(Arg201Cys) n’a été identifié que dans
une seule tumeur à cellules de Leydig
féminisante chez l’adulte (28).
Sécrétion combinée
de testostérone et d’estradiol
Symptomatologie
La symptomatologie révélatrice peut revê-
tir l’aspect d’une pseudo-puberté précoce
isosexuelle chez l’enfant prépubère, une
tumeur testiculaire et/ou une gynécomastie
chez l’adulte. Le profil hormonal associe
une augmentation du taux d’estradiol à un
taux normal ou élevé (en particulier chez
l’enfant prépubère) de testostérone. Ce
profil stéroïdien particulier s’associe, aussi
bien chez l’enfant que chez l’adulte, à un
effondrement du taux des gonadotrophines,
dont la sécrétion n’est pas modifiée par
l’administration aiguë de GnRH. Ce
tableau clinique, associant élévation des
taux plasmatiques des stéroïdes sexuels et
absence de gonadotrophines, apparaît donc
bien différent de celui observé dans les
situations précédentes (29). En effet, la
production excessive d’estradiol par une
tumeur testiculaire devrait avoir pour
conséquence, outre l’abaissement du taux
de gonadotrophines, une chute de la testo-
stéronémie. Une tumeur testiculaire andro-
génosécrétrice de l’enfant prépubère est
responsable d’une sécrétion d’estradiol
proportionnelle à celle de testostérone dont
l’estrogène est issu par aromatisation. La
clé du diagnostic, devant de tels profils hor-
monaux, repose sur la détermination de
l’hCG plasmatique (normalement indétec-
table dans le sexe masculin), ou de βhCG,
en gardant présent à l’esprit que cette der-
nière n’est pas biologiquement active.
Cadres pathologiques
L’examen clinique, complété par des exa-
mens au premier rang desquels se place
l’échographie, permettra, en règle géné-
rale, de faire le diagnostic étiologique. Les
tumeurs responsables sont des choriocarci-
nomes, hautement malins, ou des sémi-
nomes susceptibles de sécréter de l’hCG
dans 15 % à 20 % des cas. Si le séminome
se manifeste le plus habituellement sous la
forme d’une tumeur palpable, le choriocar-
cinome peut s’avérer beaucoup plus trom-
peur. En effet, la tumeur primitive peut être
imperceptible cliniquement. La sécrétion
d’hCG est alors le fait de métastases (gan-
glionnaires le plus souvent) d’une tumeur
testiculaire cliniquement imperceptible ou
d’une tumeur extra-gonadique qui, bien
que sécrétrice d’hCG, sort du cadre de
notre propos.
Mécanismes
physiopathologiques (figure 2)
Le primum movens des altérations endocri-
niennes observées dans un tel contexte rési-
de dans la sécrétion tumorale d’hCG.
L’activation des récepteurs LH/hCG des
cellules de Leydig normales stimule les
activités enzymatiques des voies ∆4 et ∆5
de la stéroïdogenèse avec, pour résultantes,
synthèse et sécrétion de stéroïdes sexuels
par le tissu leydigien sain. L’élévation com-
binée des taux de testostérone et d’estradiol
rétroagit négativement sur la sécrétion
hypothalamique de GnRH et hypophysaire
de gonadotrophines. Le caractère non sti-
mulable de la sécrétion gonadotrope, en
réponse à l’administration aiguë de GnRH,
démontre le puissant effet frénateur de
l’élévation combinée de la testostéronémie
et de l’estradiolémie (30). Ce profil s’oppo-
se à celui qui est observé au cours des
tumeurs à cellules de Leydig de l’adulte, où
seule l’estradiolémie est élevée (29).
L’existence d’un phénomène de désensibili-
sation leydigien, induit par l’hCG, explique
qu’en fonction du taux plasmatique d’hCG,
des résultats contradictoires aient été rap-
portés chez des patients atteints d’une telle
pathologie (30) :taux de testostérone nor-
maux (31, 32) ou élevés (1, 33),taux d’es-
tradiol plasmatique normaux (2) ou, au
contraire, très élevés (29, 32-34).
Le profil hormonal classique des
tumeurs sécrétrices d’hCG s’explique
donc par une production combinée de
testostérone et d’estradiol par la cellule
de Leydig normale. La conjonction

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume IV, n° 2, avril 2000 59
d’une inflation du taux de ces deux
stéroïdes bloque la sécrétion basale et
stimulée des gonadotrophines et, très
vraisemblablement, celle de GnRH
endogène.
Hypersécrétion d’inhibine
La sécrétion physiologique d’inhibine,
amorcée à la puberté sous l’influence sti-
mulante de la FSH, est essentiellement
assurée par la cellule de Sertoli. L’inhibine
B (hétérodimère associant une sous-unité α
et une sous-unité βb) est la seule forme
d’inhibine possédant, chez l’homme adul-
te, une action endocrine de rétrocontrôle
négatif sur la sécrétion hypophysaire de
FSH. Cependant, cellules de Sertoli et
gamètes ne possèdent pas l’apanage exclu-
sif de la sécrétion de ce peptide. En effet,
il a été démontré que la cellule de Leydig
était également compétente pour la syn-
thèse du peptide. La sécrétion tumorale
d’inhibine B n’a pas d’autre traduction cli-
nique qu’une réduction de la spermatoge-
nèse, à laquelle certaines tumeurs testicu-
laires s’associent, épiphénomène qui n’est
qu’exceptionnellement le symptôme révé-
lateur. Les tumeurs testiculaires dévelop-
pées primitivement aux dépens des cellules
de Sertoli et les tumeurs testiculaires à cel-
lules de Leydig féminisantes de l’adulte
s’accompagnent fréquemment d’une aug-
mentation du taux d’inhibine B plasma-
tique (8). Marqueur biologique, cette ano-
malie est également responsable de la
réduction préférentielle du taux de FSH
observée dans de telles circonstances.
Autres aspects endocriniens
des tumeurs primitivement
testiculaires
Choriocarcinomes, carcinomes embryon-
naires, tératomes, séminomes sont suscep-
tibles de sécréter peu ou prou de l’hCG.
L’α-fœto-protéine, marqueur des tumeurs
développées aux dépens du sac vitellin, est
sécrétée par trois choriocarcinomes sur
quatre, la moitié des carcinomes embryon-
naires et des tératomes et dans quelques cas
de séminomes. À côté de ces manifesta-
tions endocriniennes “classiques”, plu-
sieurs aspects particuliers on été rapportés
(tableau I, p. 60) :
–élévation des taux de prolactine ou d’hor-
mone lactogène placentaire dans les
tumeurs germinales (32) ;
–hypercalcémie paranéoplasique par sécré-
tion de PTHrp au cours de séminomes (35) ;
–élévation du taux de calcitonine plasma-
tique dans les dysembryomes (36) ;
–syndrome de Cushing (37),hyperérythro-
poïétinémie (2) ou hyperthyroïdie rattachée
à l’action TSH-like d’une sécrétion chorio-
carcinomateuse d’hCG (38).
Exceptionnellement, certaines tumeurs car-
cinoïdes testiculaires apparaissent respon-
sables d’un syndrome d’hypersérotoniner-
gie (39, 40).
Tout à fait à part, il faut citer les rarissimes
“tumeurs intrascrotales” liées à l’activation
de reliquats surrénaliens ectopiques par
hypersécrétion corticotrope (1). Elles s’ex-
pliquent par la persistance de reliquats de
tissu surrénalien le long du trajet migra-
toire embryonnaire du testicule. Elles s’ob-
servent dans des contextes pathologiques
particuliers qui ont en commun une infla-
tion des taux d’ACTH plasmatique : blocs
enzymatiques surrénaliens (20) ou syndro-
me de Nelson (22). Le volume de ces
tumeurs intrascrotales s’accroît sous l’in-
fluence de l’ACTH et, au contraire, régres-
se après inhibition adéquate de la sécrétion
corticotrope.
Figure 2. Conséquences endocriniennes d’une hypersécrétion tumorale d’hCG inductrice d’une hyper-
sécrétion combinée de testostérone et préférentiellement de 17-
β
-estradiol.
OP : neurones opioïdergiques ; NT : neurotransmetteur.
 6
6
 7
7
1
/
7
100%