Lire l'article complet

76 | La Lettre de l’Infectiologue • Vol. XXIII - n° 3 - mai-juin 2008
MISE AU POINT
Diarrhée du voyageur :
de la gestion
sur place ou au retour
à la prévention
Traveler’s diarrhea: from treatment to prevention
Olivier Bouchaud*
* Consultation du voyage et de méde-
cine tropicale, hôpital Avicenne et
université Paris-XIII, Bobigny.
L
a diarrhée du voyageur (DV), appelée commu-
nément “turista” (ou plus exotiquement par
un flot de termes plus imagés : revanche de
Montezuma, kaboulite, GI’s, Gyppy tummy, Casa-
blanca crud, Turkey trot, Trotsky’s, Hong Kong ou
Malta dog, barsa belly, Aden gut, Delhi belli, Poonah
Pooh, Aztec two step, la Djerbienne...), est marquée
par une certaine banalité compte tenu de sa grande
fréquence et de son habituelle bénignité. Il faut
néanmoins garder à l’esprit que cet incident peut
évoluer vers une pathologie sévère, soit du fait du
terrain (jeunes enfants ou personnes âgées), soit du
fait d’une prise en charge inadéquate. Par ailleurs les
conséquences “fonctionnelles” qu’elle entraîne sont
de moins en moins acceptées par les voyageurs, qui
voient une partie de leur séjour ainsi gâché. Enfin,
son coût pour la collectivité est loin d’être négli-
geable du fait du nombre de personnes concernées :
une étude jamaïcaine a évalué le coût de la DV à
116 $ US par patient et 27 $ US $ par voyageur, ce
qui a permis aux auteurs d’arriver par extrapolation à
un coût variant de 13 à 44 $ US par voyageur et par
séjour, selon l’incidence saisonnière et les conditions
de voyage (1). Considérant que près de 4,5 millions
de résidents français voyagent chaque année en zone
tropicale, on arrive théoriquement à un montant
étonnant d’environ 40 à 140 millions d’euros pour
la seule DV. C’est dire tout l’intérêt qu’il y aurait à
disposer d’une prévention efficace, bon marché et
sans risque, ce qui est loin d’être le cas actuellement
et ne le sera pas dans un avenir proche.
Épidémiologie
Définition
La définition de la DV varie selon les auteurs. La plus
couramment utilisée est la survenue d’au moins
trois selles de consistance anormale pendant 24 h,
associées ou non à au moins un symptôme d’accom-
pagnement (vomissements, douleurs abdominales,
fièvre…) [2]. Cette définition ne prend cependant pas
en compte le niveau de gêne ressentie par le voya-
geur, une seule selle aqueuse impérieuse dans un lieu
sans toilettes à proximité étant bien plus invalidante
que plusieurs exonérations “contrôlables”.
Prévalence et facteurs de risque
Globalement, c’est le problème de santé le plus
fréquent pour les voyageurs se rendant d’une zone
à niveau d’hygiène élevé vers un pays à niveau d’hy-
giène faible, ce qui concerne environ 4,5 millions de
personnes tous les ans en France. Le taux d’attaque
moyen est d’environ 40 à 50 %, avec des extrêmes
jusqu’à 90 % dans certaines études (2, 3).
Le risque de faire une turista varie en fonction de
plusieurs facteurs. Les sujets jeunes sont plus exposés
du fait d’une moindre immunité spécifique et du fait
de conditions de voyage généralement plus exposées
(contact avec la population, conditions d’hygiène
LI MAI-JUIN 2008.indd 76 3/07/08 17:12:59

La Lettre de l’Infectiologue • Vol. XXIII - n° 3 - mai-juin 2008 | 77
Résumé
La diarrhée du voyageur est un des problèmes de santé les plus fréquents chez les voyageurs, avec une incidence
mensuelle de l’ordre de 50 %. La diarrhée peut avoir des conséquences médicales, notamment aux âges extrêmes de la
vie, elle peut gêner considérablement le séjour et se compliquer du syndrome de l’intestin irritable. Les étiologies sont
essentiellement bactériennes, principalement
Escherichia coli
entéro-toxinogène (ETEC). Les aliments solides, davantage
que l’eau de boisson, en sont les vecteurs principaux.
L’efficacité des antibiotiques (quinolones, azithromycine) ne doit pas faire oublier que l’essentiel du traitement reste
la réhydratation. L’utilisation des antibiotiques en prévention a des indications parcimonieuses. Les règles d’hygiène
alimentaire doivent se concentrer sur le lavage des mains et la consommation d’aliments sans risque (tout ce qui est
cuit et servi brûlant). L’avenir de la prévention repose sur les anti-infectieux non absorbables et sur les vaccins actifs
notamment contre l’ETEC.
»
»
Mots-clés
Diarrhée
Voyage
Quinolones
Azithromycine
Prévention
Summary
Travel diarrhea is one of the
main health impairments in
travelers, with an attack rate
of approximately 50%. Except
for aged travelers or young
children, where severe cases
are possible, travel diarrhea
is usually mild but can lead
to significant discomfort and
to irritable bowel syndrome.
Bacteria, particularly entero-
toxinogene
E. coli (ETEC)
, are
the main causes. More than
drinking water, consumption of
unsafe solid food is the main
at-risk attitude. Quinolones and
azithromycin are very effective
whereas rehydration remains
the corner stone of the treat-
ment. Quinolones can be used
as a preventive treatment but
indications should be limited
to high-risk travelers. Other
preventive measures include
food hygiene, with focus on
hand washing and consump-
tion of hot dishes. In the future,
prevention could rely on the use
of non-absorbed antiinfective
agents and vaccination against
ETEC
.
Keywords
Diarrhea
Travel
Quinolones
Azithromycin
Prevention
parfois plus précaires, voyage plus itinérant). Une
comorbidité associée sous-jacente (maladie chronique
telle que diabète ou déficit immunitaire, notamment
infection par le VIH) et toute atteinte de l’intégrité de
la barrière naturelle représentée par l’acidité gastrique
(gastrectomie, hypo- ou achlorydrie, traitement
antiulcéreux...) vont non seulement entraîner un
risque accru de diarrhée mais également des formes
plus sévères. Des facteurs génétiques encore très mal
connus jouent vraisemblablement un rôle : sujets
de groupe sanguin O plus sensibles aux shigelloses
(Shigella sonnei) et au choléra, susceptibilité à Esche-
richia coli entéro-toxinogène (ETEC) [3-7].
Les facteurs de risque liés au comportement
alimentaire sont difficiles à cerner, car variables
(voire opposés) d’une étude à l’autre. Ainsi, une
étude faite au Népal a montré que le fait de boire
de l’eau du robinet et de manger dans les restau-
rants de rue était moins à risque que manger des
plats “internationaux” et aller dans les restaurants
“européanisés” (8).
À côté de ces facteurs individuels interviennent bien
évidemment, et de façon déterminante, des facteurs
d’environnement et d’écologie microbienne locaux,
reflet du niveau d’hygiène général (notamment au
sein du personnel de la chaîne alimentaire). Ainsi, il a
été montré que les efforts dans ce domaine réalisés
en Tunisie se sont traduits par une diminution du
risque de troubles digestifs (4). On classe schémati-
quement les pays en trois groupes selon leur niveau
sanitaire et le risque de DV (tableau I).
Délai de survenue,
durée et conséquences
fonctionnelles
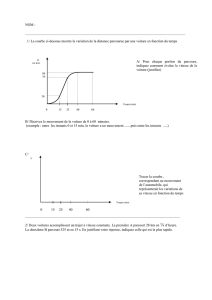
L’incubation de la DV est habituellement brève (de
quelques heures à quelques jours) et le premier pic
de fréquence se situe dès le 3e-4e jour du séjour.
Un deuxième pic survient vers le 10
e
jour ; les
troubles digestifs peuvent survenir même après
le retour.
Dans la grande majorité des cas, il s’agit d’un événe-
ment bénin et de courte durée (un à cinq jours).
Cependant, dans 40 % des cas, ces troubles digestifs
amènent le voyageur à modifier son emploi du temps
(une étude a montré que la turista “coûtait” en
moyenne 10 % du temps du séjour à ses “victimes”)
et le conduisent à un alitement de quelques jours
(avec hospitalisation dans moins de 1 % des cas)
dans 20 à 30 % des cas. Dix pour cent des DV durent
plus d’une semaine et 2 % évoluent vers des formes
chroniques avec un retentissement fonctionnel
parfois plus important (1, 4, 9). Par ailleurs, la DV
est à l’origine du syndrome de l’intestin irritable
postinfectieux (10, 11). Cette complication de la
DV déjà évoquée il y a une quinzaine d’années a
été confirmée par des études récentes : chez des
étudiants américains ayant séjourné au Mexique,
10 % de ceux qui ont eu une DV pendant leur séjour
ont ensuite développé un syndrome de l’intestin
irritable (10).
Tableau I. Évaluation du risque de diarrhée pour le voyageur en fonction du niveau d’hygiène de son pays d’origine et de
celui du pays visité.
Risque de diarrhée (%)
Niveau d’hygiène du pays d’origine Niveau d’hygiène du pays visité
Faible*** Intermédiaire** Élevé*
Élevé* 40 10 2 à 4
Intermédiaire** 8 à 18 – –
Faible*** – 8 à 18 2 à 14
* Amérique du Nord, Europe de l’Ouest et du Nord, Australie, Nouvelle-Zélande, Japon.
** Pourtour méditerranéen, Moyen-Orient, Chine, ex-URSS, Europe de l’Est.
*** Amérique latine, Afrique, Asie du Sud-Est.
LI MAI-JUIN 2008.indd 77 3/07/08 17:13:01

78 | La Lettre de l’Infectiologue • Vol. XXIII - n° 3 - mai-juin 2008
Diarrhée du voyageur : de la gestion sur place
ou au retour à la prévention
MISE AU POINT
Étiologies
et sources microbiennes
L’infection digestive provient de l’absorption d’ali-
ments ou d’eau contaminés. L’origine commune de la
contamination est les matières fécales de personnes
infectées. Les ingestats alimentaires représentent le
vecteur essentiel des germes, le rôle du contact direct
par les mains ou celui indirect des mouches, bien que
certain, apparaissant secondaire. Les aliments solides
sont plus souvent en cause que l’eau de boisson, des
études ayant montré que jusqu’à 70 % des produits
de base (testés sur les marchés) étaient contaminés
(12). Certains aliments, comme les viandes et les
poissons mal cuits ou refroidis, sont plus à risque
que d’autres (tableau II) [3].
Les étiologies sont en effet essentiellement infec-
tieuses, même si des facteurs non infectieux (psycho-
gènes, modification du rythme de vie, décalage
horaire, changement de climat ou d’alimentation,
épices) peuvent avoir une action favorisante ou
directe (diarrhée motrice).
Parmi les agents infectieux en cause (tableau III),
les bactéries, notamment ETEC, sont à l’origine de
près de 80 % des DV. Les autres étiologies se parta-
gent entre les étiologies virales et, à un moindre
degré, parasitaires (1, 2, 4, 11, 13). Le rôle de certains
parasites “émergents” (Cyclospora, cryptosporidies,
microsporidies, Isospora belli) a été mis en évidence
mais reste encore secondaire (14). Le vibrion cholé-
rique ne concerne que très rarement le voyageur
occidental (risque évalué : de 1 pour 500 000 voya-
geurs en zone d’endémie à moins de 0,001 % par
mois d’exposition) [4, 15].
Si ETEC apparaît généralement comme la cause
bactérienne de loin la plus fréquente, la prévalence
respective des différents micro-organismes est très
variable dans les (nombreuses) études disponibles,
qui montrent des variations importantes selon la
zone géographique, la saison (incidence plus élevée
en saison chaude et/ou humide) et les conditions
de voyage (notamment d’hôtellerie) [7, 13]. Il est
difficile de synthétiser ces variations, mais on peut
retenir quelques associations de risque plus spéci-
fique selon la zone géographique : le risque de DV
liée aux parasites (Cyclospora, Giardia et cryp-
tosporidies) est plus élevé au Népal, au Pérou, à
Haïti et en Russie (particulièrement Saint-Péters-
bourg pour Giardia et cryptosporidies) et le risque
de Campylobacter jejuni (notamment résistant
aux quinolones) est plus important en Thaïlande
(16). Dans ces variations de prévalence, signalons
deux phénomènes épidémiologiques nouveaux :
la montée en puissance d’E. coli entéroagrégatif,
et la résistance des entéropathogènes (notam-
ment shigelles, salmonelles et campylobacters)
aux antibiotiques, y compris les plus récents, tout
particulièrement en Asie du Sud-Est (13, 17, 18). S’il
y a une vingtaine d’années, le pourcentage de DV
restant sans étiologie était élevé, les progrès dans
les techniques d’identification des micro-organismes
ont permis pratiquement d’inverser cette propor-
tion à environ 20 % de pathogènes en cause non
identifiés (16).
Tableau II. Classification des aliments en fonction du risque de contamination.
Aliments à risque Aliments sans (ou à faible) risque
– Fruits de mer
– Poissons et viandes mal cuits
– Plats préparés consommés froid
– Glaces artisanales
– Crudités
– Fruits préépluchés
– Lait et produits laitiers
– Aliments avec traces de moisissures
– Eau du robinet
– Boissons non encapsulées
– Plats cuits consommés chauds
– Pain, biscuits et aliments secs
– Confiture, miel
– Fruits épluchés par le voyageur
– Eau et boissons encapsulées
– Eau décontaminée (ébullition, filtrage, agents
chimiques…)
– Boissons chaudes
Tableau III. Principales étiologies microbiennes de la diar-
rhée du voyageur.
Bactéries
(80 %)
E. coli
entéro-toxinogène
E. coli
entéro-agrégatif
Shigelles
Campylobacter
E. coli
entéro-invasif
Salmonelles
Aeromonas
Vibrions non cholériques
Plesiomonas shigelloïdes
E. coli
entéro-pathogène
Staphylocoques
Vibrion cholérique
Yersinia enterocolitica
Virus
(10 à 20 %)
Rotavirus
Virus Norwalk
Adénovirus
Astrovirus
Entérovirus
Calicivirus
Parasites
(5 à 10 %)
Giardia intestinalis
E. histolytica
Cryptosporidium
, microsporidies
Isospora belli
Cyclospora sp
LI MAI-JUIN 2008.indd 78 3/07/08 17:13:05

La Lettre de l’Infectiologue • Vol. XXIII - n° 3 - mai-juin 2008 | 79
MISE AU POINT
Conduite à tenir
en cas de diarrhée aiguë
La particularité de la DV est que, dans la grande
majorité des cas, c’est le voyageur lui-même qui se
traite pendant son séjour. Le praticien, et particuliè-
rement le généraliste, a donc un rôle pédagogique
important à jouer, par les conseils donnés avant le
départ et la constitution de la pharmacie de voyage.
Dans les cas où la diarrhée survient après le retour, le
praticien n’est évidemment pas confronté aux mêmes
problèmes diagnostiques. La distinction entre diar-
rhée toxinique (diarrhée aqueuse sans fièvre et avec
vomissements) et diarrhée invasive (selles glairo-
sanglantes, fièvre, douleurs abdominales) est clinique-
ment aléatoire et d’un intérêt pratique limité (3).
La démarche clinique la plus importante est de
dépister les signes précurseurs de complications.
Les difficultés sont en fait essentiellement liées au
choix d’un juste équilibre entre une “médicalisa-
tion” excessive ou au contraire insuffisante. Ainsi,
la réalisation d’examens coprologiques d’emblée a
un intérêt limité du fait d’une part de la “rentabilité”
limitée des coprocultures standard, de l’habituelle
efficacité des antibiotiques actifs (si indication) et
de la rareté des causes parasitaires dans les formes
aiguës.
Traitement symptomatique
La première règle à observer dans tous les cas est la
compensation hydroélectrolytique. Le voyageur doit
être sensibilisé à ce traitement de base nécessaire,
très souvent suffisant et pourtant méconnu. Son
importance est d’autant plus grande si la diarrhée
est abondante, si elle dure dans le temps, si elle est
associée à des vomissements et si elle survient sur
un terrain fragilisé (jeunes enfants, personnes âgées,
maladies sous-jacentes, traitements par diuréti-
ques, digitaliques, lithium...). Elle se fera, dans la
grande majorité des cas, par voie orale, en veillant à
absorber une quantité suffisante de sel, l’utilisation
de préparations spéciales (de type soluté OMS) ne
semblant pas apporter de bénéfice évident (19).
Ainsi, du thé léger sucré ou des jus de fruit avec des
gâteaux secs salés font parfaitement l’affaire. Il est
conseillé d’éviter les produits lactés. En revanche,
une alimentation riche en glucides est recommandée,
car elle favorise l’absorption hydrosodée. En cas
de vomissements, plutôt que les antiémétiques,
d’intérêt modéré, la prise répétée de petites quan-
tités de liquide permettra généralement de passer
le cap difficile. Cependant, dans quelques cas, la
réhydratation par voie intraveineuse, même brève,
sera nécessaire devant l’existence de vomissements
incoercibles ou d’une diarrhée hydrique majeure
(3-5, 11, 20).
Les ralentisseurs du transit intestinal (de type
lopéramide et dérivés) ont l’avantage d’agir très
rapidement, mais, outre leur caractère illogique
sur le plan physio-pathologique (allongement du
temps de contact germe/muqueuse), ils ont l’in-
convénient d’entraîner parfois un inconfort digestif
secondaire (douleurs abdominales, constipation
prolongée...), voire dans de rares cas des complica-
tions coliques graves (perforations) [21]. Au-delà des
contre-indications en cas de syndrome dysentérique
(diarrhée de type invasif) et chez le jeune enfant, ils
ne devraient être utilisés qu’avec parcimonie en se
limitant aux situations d’urgence (3). Les protec-
teurs de la muqueuse intestinale (adsorbants), tels
que la diosmectite ou l’attapulgite, ont une effica-
cité difficile à mesurer, certainement moindre que
les ralentisseurs du transit, avec une réduction de
l’ordre de 50 % de la durée d’évolution de la diarrhée
mais sans effets indésirables du fait de l’absence
de passage systémique (22). Les antisécrétoires,
essentiellement représentés par le racécadotril, ont
une efficacité révélée comparable à celle de l’oxyde
de lopéramide (23).
Anti-infectieux
Le voyageur peut parfois être amené à utiliser des
antibiotiques, soit en autotraitement, soit après
une consultation médicale. Les attitudes diffèrent
selon les auteurs, avec des tendances plus inter-
ventionnistes en Amérique du Nord. Les antibio-
tiques sont raisonnablement justifiés en présence
d’une diarrhée de type entéro-invasif (syndrome
dysentérique avec fièvre et présence de sang ou de
glaires dans les selles), d’un tableau sévère, lorsqu’un
traitement symptomatique de plus de 48 heures est
inefficace et si la diarrhée survient sur un terrain
fragilisé (3, 24).
Les quinolones représentent le traitement de choix :
norfloxacine (400 mg x 2/j), ofloxacine (200 mg x 2/j),
ciprofloxacine (500 mg x 2/j) pendant 3 jours, sauf
en cas de syndrome dysentérique, où la durée recom-
mandée est de 5 jours. Certains auteurs ont proposé
des traitements en dose unique (2 comprimés), avec
des résultats satisfaisants (2, 11, 20, 25). Plus récem-
ment, l’azithromycine a également fait la preuve de
son efficacité en dose unique de 1 g (26, 27).
Le non-respect des règles d’hy-
giène alimentaire est le principal
facteur de risque de diarrhée du
voyageur (Dakar, Sénégal).
LI MAI-JUIN 2008.indd 79 3/07/08 17:13:08

80 | La Lettre de l’Infectiologue • Vol. XXIII - n° 3 - mai-juin 2008
Diarrhée du voyageur : de la gestion sur place
ou au retour à la prévention
MISE AU POINT
Des antibiotiques non absorbables (limitant donc
le risque d’effets indésirables) tels que la rifaximine
(non disponible en France) ou la bicozamycine, ainsi
que les probiotes pourraient être intéressants. Leur
évaluation est en cours, ou avérée pour la rifaximine
(20, 25).
Les antiseptiques intestinaux (nitrofurane, quino-
léine) n’ont a priori pas leur place, leur efficacité
n’ayant jamais été démontrée.
Diarrhées persistantes
et chroniques (28, 29)
Dans 10 % des cas environ, les troubles digestifs
persistent au-delà de deux semaines ; dans 2 % des
cas, ils deviennent chroniques (de un à six mois, voire
plus), avec habituellement une à trois selles molles
par jour, en alternance parfois avec des épisodes d’ap-
parente normalisation, parfois accompagnés d’une
anorexie et d’un état dyspeptique. Il est alors recom-
mandé de réaliser dans un premier temps, des explo-
rations microbiologiques, notamment avec examens
parasitologiques des selles. La probabilité de mettre
en évidence une parasitose (giardiase, amibiase, voire
cyclosporose ou helminthiase) est, en effet, plus
importante que dans les diarrhées aiguës. Si l’examen
coprologique est négatif, un traitement empirique par
des dérivés imidazolés (métronidazole) éventuelle-
ment associé à un traitement antibiotique (quinolone,
azithromycine) doit être tenté avant de discuter des
explorations plus complètes (coloscopie). En effet, la
révélation d’une pathologie intestinale (notamment
colite inflammatoire) à l’occasion d’une DV n’est pas
rare. Il est cependant courant que ces troubles diges-
tifs restés sans explication régressent spontanément
et progressivement au bout de plusieurs mois. Bien
que devenue très rare, la possibilité d’une sprue tropi-
cale (tableau souvent sévère de malabsorption) doit
être évoquée, surtout chez l’expatrié ou le voyageur
au long cours (notamment en Asie) [30]. Beaucoup
de ces troubles digestifs chroniques se révèleront
relever du syndrome de l’intestin irritable (10).
Prévention de la turista
Conseils pour l’hygiène alimentaire
En dépit du célèbre adage Boil it, cook it, peel it or
forget it, les précautions recommandées dans ce
domaine sont d’un intérêt relatif, car leur efficacité
(bien que peu évaluée) n’a jamais été démontrée
(à l’exception notable du lavage des mains... pourtant
rarement cité dans les conseils !). Leur application est
rendue difficile par le fait que le voyageur, surtout
itinérant, ne prépare pas lui-même ses repas.
La règle de base est que tout ce qui est cuit et servi
brûlant (une température de plus de 65 °C empêche
le développement de micro-organismes) est sans
risque (3, 20, 25). La consommation d’un plat
préparé devant le voyageur et servi chaud dans un
restaurant de rue est souvent moins à risque qu’un
buffet (souvent tiède) d’hôtel “international” (8).
Par ailleurs, certains aliments (tableau II) sont sans
(ou à faible) risque.
Concernant l’eau et les boissons, les précautions
habituelles restent de rigueur : boissons encapsulées
(on trouve des eaux minérales de bonne qualité dans
la quasi-totalité des pays en développement) ou
décontaminées par ébullition (au moins une minute).
La désinfection chimique (d’efficacité modeste, bien
que des produits récents – Aquatabs
®
, Micropure
Forte® – soient intéressants) doit être associée à la
filtration mécanique sur céramique (très efficace ; des
dispositifs individuels sont disponibles) [20, 25].
Prophylaxie médicamenteuse
Ce domaine a donné lieu à de nombreuses études
(essentiellement aux États-Unis), qui ont toutes
montré la grande efficacité (80 à 100 %) des quino-
lones en une prise quotidienne pendant la période
d’exposition (20, 25). À l’exception peut-être du
cotrimoxazole dans certaines zones, les macrolides,
les ampicillines et les cyclines sont sans intérêt du
fait de l’extension des résistances. Les indications,
assez larges en Amérique du Nord, doivent être
raisonnablement très limitées, fondées sur l’éva-
luation du rapport coût et risques sur bénéfice, la
démarche essentielle consistant à identifier les sujets
à risque (tableau IV). Les effets indésirables, bien
que peu courants et habituellement bénins (toxi-
dermie, photodermatose, mycose génitale, céphalées,
vertiges, nausées...) doivent donc être pris en compte,
d’autant que, malgré leur rareté, certains peuvent
être sévères (allergie grave, colite postantibiotique...).
L’impact sur la sélection de mutants résistants ne doit
pas être négligé, bien que le risque apparaisse faible.
Par ailleurs, ces indications doivent être limitées à des
séjours brefs (moins de 2 à 3 semaines).
En pratique, la décision sera prise au terme d’un
dialogue entre le médecin et le voyageur, en tenant
compte, d’un côté, de la durée, des conditions du
LI MAI-JUIN 2008.indd 80 3/07/08 17:13:08
 6
6
 7
7
1
/
7
100%