Cas clinique M Pathologie thyroïdienne à double dose

Métabolismes Hormones Diabètes et Nutrition (VIII), n° 1, janvier/février 2004
Cas clinique
Cas clinique
41
Métabolismes Hormones Diabètes et Nutrition (VIII), n° 1, janvier/février 2004
Pathologie thyroïdienne à double dose
J.M. Kuhn*
M
onsieur J.V., âgé de 61 ans, consulte en pneumologie
en raison de l’apparition, quelques semaines plus tôt,
d’une dyspnée. Le bilan réalisé chez ce patient aux
antécédents tabagiques (36 paquets/année) ne retrouve qu’une
surélévation de la coupole diaphragmatique gauche, traduc-
tion d’une paralysie phrénique homolatérale dont la cause pré-
cise ne pourra être déterminée. Le scanner thoracique réalisé
dans le cadre de l’enquête étiologique retrouve une hypertro-
phie du lobe thyroïdien droit à développement endothoracique.
Le patient est alors adressé en consultation d’endocrinologie.
Monsieur J.V. ne se plaint d’aucun autre symptôme que la dys-
pnée. Il mesure 1,64 m et pèse 69 kg, c’est-à-dire 2 kg de moins
que deux mois auparavant. Son rythme cardiaque est régulier,
à 75 pulsations/mn, et sa pression artérielle est à 140/80 mmHg.
Il existe un discret tremblement des extrémités et une moiteur
de la paume des mains. La palpation cervicale retrouve un petit
goitre ferme, polynodulaire, qui ne s’accompagne d’aucun
signe de compression locale ni d’adénopathie satellite. L’écho-
graphie thyroïdienne met en évidence une hypertrophie mul-
tinodulaire du lobe thyroïdien droit. La TSH plasmatique est
à 0,03 mU/l (N : 0,1-4,5), la T4 libre à 18,8 pmol/l (N : 10-23).
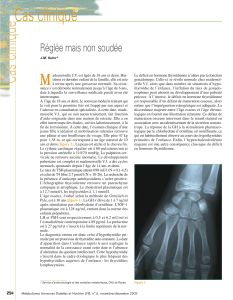
Une scintigraphie thyroïdienne au technétium complète ce
bilan
(figure 1).
Le taux de calcitonine plasmatique, mesuré
en raison du caractère nodulaire de l’hypertrophie thyroï-
dienne, est inférieur à 10 ng/l (n < 10).
Le tableau réalisé est donc celui d’une hyperthyroïdie sur goitre
multinodulaire plongeant. L’absence de signe d’ophtalmopa-
thie et la négativité de la recherche de la présence d’anticorps
liant le récepteur de la TSH sont en défaveur de l’hypothèse
d’un goitre “basedowifié”. Le diagnostic retenu est donc celui
de goitre multi-hétéronodulaire toxique. L’on a opté pour une
préparation médicale par antithyroïdien de synthèse avant réa-
lisation d’une thyroïdectomie. L’acte chirurgical, qui revêt le
double objectif de traiter radicalement l’hyperthyroïdie et de
lever tout risque de compression trachéale par le goitre plon-
geant, est effectué après trois mois de traitement par antithy-
roïdien de synthèse chez un patient devenu euthyroïdien cli-
niquement et biologiquement. L’examen anatomopathologique
définitif de la pièce de thyroïdectomie subtotale bilatérale
conclut à une hyperplasie nodulaire thyroïdienne bénigne avec
remaniements dystrophiques. L’hypothyroïdie postchirurgi-
cale est alors compensée par la prise quotidienne de 75 µg de
LT4 par jour.
Pendant les cinq années qui suivent l’intervention thyroï-
dienne, monsieur J.V. reste parfaitement euthyroïdien tant sur
le plan clinique que sur le plan biologique (TSH : 2 mU/l). Tou-
tefois, à cette période, le patient est hospitalisé en raison de la
survenue, 10 jours auparavant, d’œdèmes des membres infé-
rieurs. S’y associent une asthénie, des crampes musculaires et
une constipation. Le bilan biologique retrouve une kaliémie à
2 mmol/l. Le patient est normotendu et ne suit pas de traite-
ment susceptible d’induire une telle hypokaliémie. La symp-
tomatologie clinique et biologique conduit, d’une part, à initier
une supplémentation potassique et, d’autre part, à effectuer une
enquête étiologique. Celle-ci débouchera rapidement sur le
diagnostic de syndrome de Cushing : ACTH oscillant entre 140
et 600 pg/ml au cours du nycthémère (N : 10-80), cortisol plas-
matique évoluant parallèlement entre 1 690 et 3 000 nmol/l
(N : 250-850), cortisol libre urinaire 16 380 nmol/24 h
(N < 220).
L’âge du patient, l’évolutivité du processus endocrinien, la pro-
fondeur de l’hypokaliémie et les résultats de l’enquête hor-
monale amènent au diagnostic de syndrome de Cushing para-
néoplasique. L’hypothèse d’un carcinome bronchique est celle
qui vient en tête de liste du fait de sa fréquence et en raison
des antécédents tabagiques du patient. Les différentes inves-
tigations réalisées chez monsieur J.V. permettront d’écarter
* Service d’endocrinologie et des maladies métaboliques, CHU de Rouen.
Figure 1. Aspect scintigraphique de l’hypertrophie thyroïdienne.
Face antérieure

42
Métabolismes Hormones Diabètes et Nutrition (VIII), n° 1, janvier/février 2004
Cas clinique
Cas clinique
cette hypothèse. La mesure de la sérotonine plasmatique et de
ses métabolites urinaires, marqueurs d’une tumeur carcinoïde,
révélera à plusieurs reprises des chiffres normaux. Le scanner
abdominal ne retrouve pas d’anomalie pancréatique, mais la
présence d’images hépatiques lacunaires très évocatrices de
localisations métastatiques
(figure 2).
La clé du diagnostic
sera obtenue par une double approche : réalisation d’une biopsie
hépatique sous échographie, qui permettra une étude immuno-
histochimique d’une lésion métastatique, et mesure du taux de
calcitonine plasmatique qui, à cette date, dépasse 1 500 ng/l.
La relecture des lames de la pièce de thyroïdectomie et un com-
plément d’immunomarquage anticalcitonine ne retrouveront
pas de foyer de carcinome médullaire de la thyroïde.
Supplémentation potassique et initiation d’un traitement par
kétoconazole permettront d’améliorer transitoirement la situa-
tion. En dépit de ce traitement, monsieur J.V. décédera trois
mois plus tard dans un tableau de syndrome de Cushing galo-
pant.
Cette observation montre qu’un carcinome médullaire de la
thyroïde peut s’accompagner, au moins initialement, d’un taux
normal de calcitonine
(1)
ou se développer sur un moignon
thyroïdien résiduel après thyroïdectomie subtotale bilatérale ;
elle met aussi en évidence que l’apparition d’un syndrome de
Cushing paranéoplasique
(2)
représente un tournant évolutif
du carcinome médullaire, tournant après lequel il se situe au-
dessus des ressources thérapeutiques curatrices possibles.
Références
1.
Cohen R, Campos JM, Salaun C et al.Preoperative calcitonin levels are pre-
dictive of turn or size and postoperative calcitonin normalization in medullary
thyroid carcinoma. Groupe d’étude des tumeurs à calcitonine (GETC). J Clin
Endocrinol Metab 2000 ; 85 : 919-22.
2.
Smallridge RC, Bourne K, Pearson BW et al. Cushing’s syndrome due to
medullary carcinoma : diagnosis by proopiomelanocortin messenger ribonu-
cleic acid in situ hybridization. J Clin Endocrinol Metab 2003 ; 88 : 4565-8.
Figure 2. Scanner de la région abdominale objectivant des images
hépatiques lacunaires.
TAHOR
1
/
2
100%