L’ L’ischémie intestinale aiguë Acute intestinal ischemia

* Service de chirurgie adulte Ouest, hôpital Claude-Huriez, CHRU de Lille.
L’ischémie intestinale aiguë
Acute intestinal ischemia
●P. Zerbib, L. Gambiez*
L’
ischémie intestinale aiguë (IIA) est une urgence vitale
dont la prévalence est estimée à 0,9 % des hospita-
lisations pour douleur abdominale et à 0,4 % des
laparotomies effectuées en urgence. Son incidence semble être en
constante augmentation. Elle est la conséquence d’une inadéqua-
tion entre les besoins et les apports en oxygène dans le territoire
splanchnique irrigué par le tronc cœliaque et les artères mésenté-
riques. La forme la plus grave de l’ischémie intestinale se traduit
par l’infarctus intestinal. Sous le terme d’IIA, on distingue l’isché-
mie intestinale occlusive,d’origine artérielle (thrombotique et
embolique) et veineuse (infarcissement veineux intestinal), et
l’ischémie intestinale non occlusive (à vaisseaux perméables).
Récemment, l’American Gastroenterological Association (AGA)
a classé l’ischémie digestive en trois catégories, centrées sur la
présentation clinique : l’ischémie intestinale aiguë, l’ischémie intes-
tinale chronique (angor digestif) et la colite ischémique. L’ischémie
intestinale aiguë a regroupé les ischémies par obstruction artérielle
majeure et mineure, les embolies artérielles majeures, les throm-
boses veineuses mésentériques et les vasoconstrictions splanch-
niques (ischémies non occlusives). Toutes ces formes ont en
commun un défaut de perfusion splanchnique, des phénomènes
de translocation bactérienne et une réaction systémique inflamma-
toire. Cependant, la physiopathologie de l’IIA, particulièrement
pour les ischémies non occlusives, reste peu claire. La présentation
clinique, la démarche diagnostique et le traitement de chacune
des formes d’IIA peuvent être très différents. Le taux de morta-
lité est élevé, de 60 à 90 % selon les séries. Cependant, une étude
rétrospective récente révèle que le pronostic semble s’améliorer
ces dernières années, avec un taux de mortalité à 48 % (1). Le pro-
nostic de cette pathologie reste corrélé à la précocité diagnostique,
à l’étendue de l’ischémie intestinale et aux moyens thérapeutiques
adaptés de revascularisation et de sauvetage digestif.
ANATOMIE DE LA VASCULARISATION SPLANCHNIQUE
Les trois artères principales
–Le tronc cœliaque (TC) : il vascularise l’étage sus-mésocolique
de l’abdomen (foie, vésicule biliaire, rate, estomac, pancréas).
–L’artère mésentérique supérieure (AMS) : elle vascularise
l’ensemble du grêle, le côlon droit et les deux tiers droits du côlon
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005 151
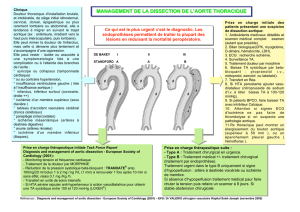
POINTS FORTS
POINTS FORTS
■L’ischémie intestinale regroupe des pathologies distinctes
nécessitant des traitements très différents.
■Le diagnostic est difficile en raison d’une séméiologie peu
spécifique, et le pronostic global est mauvais.
■L’infarcissement veineux intestinal est de meilleur pro-
nostic. Son traitement est surtout médical par une anticoagu-
lation prolongée.
■Toute douleur abdominale chez un patient polyvasculaire
doit évoquer une ischémie mésentérique aiguë.
■Il faut être attentif aux douleurs abdominales postprandiales
précoces pour dépister les formes chroniques de l’ischémie
intestinale.
■L’artériographie cœliomésentérique peut apporter le dia-
gnostic de certitude et constitue la première étape du traite-
ment. Si l’on suspecte un infarcissement veineux, la tomo-
densitométrie abdominale avec injection doit être l’examen
de référence.
■La rapidité de prise en charge constitue un facteur pronos-
tique primordial.
■Le traitement de l’ischémie intestinale aiguë est aujourd’hui
multidisciplinaire et associe dans une même urgence les chirur-
giens, les anesthésistes réanimateurs, les urgentistes et les
radiologues.
■Le traitement des ischémies intestinales occlusives arté-
rielles repose sur les revascularisations mésentériques au stade
de lésions intestinales réversibles, et sur les résections diges-
tives étendues en cas d’infarctus constitué.

DOSSIER THÉMATIQUE
transverse. Son débit à l’état basal est d’environ 400 ml/s et double
en période postprandiale. Son rôle prépondérant dans la vasculari-
sation splanchnique est actuellement bien établi.
–L’artère mésentérique inférieure (AMI) : elle vascularise le tiers
gauche du côlon transverse et le côlon descendant. Elle est throm-
bosée de façon asymptomatique chez 70 % des patients de plus
de 70 ans.
Selon la règle de Mikkelsen, il faut une obstruction d’au moins 2 des
3troncs artériels pour qu’une ischémie intestinale s’installe (2).
Cette règle est à nuancer : l’obstruction doit porter majoritaire-
ment sur l’AMS, dont l’atteinte module la gravité de la symptoma-
tologie.
La circulation artérielle de suppléance
La vascularisation splanchnique est originale du fait de l’existence
d’un riche réseau de circulation de suppléance entre les trois troncs
artériels principaux, limitant les conséquences digestives d’une obs-
truction artérielle. Par exemple, l’arcade de Riolan, qui anastomose
l’AMS et l’AMI, a la particularité de pouvoir circuler dans les deux
sens, revascularisant une thrombose proximale de l’AMS à partir
de l’AMI, et vice-versa.
Vascularisation veineuse
Elle se calque sur la vascularisation artérielle. La réunion des veines
mésentériques et de la veine splénique forme la veine porte.
PHYSIOPATHOLOGIE
Le débit cardiaque destiné à l’intestin passe de 20 % à l’état basal
à 35 % en période postprandiale. Soixante-dix à 90 % de ce débit
sont destinés à la muqueuse intestinale, qui est responsable d’envi-
ron 90 % de la consommation en oxygène totale de l’intestin. Lors
d’une diminution du flux splanchnique, la réponse intestinale locale
vise à privilégier le plus longtemps possible la perfusion de la
muqueuse, dont la demande métabolique est particulièrement
élevée. Une consommation normale en oxygène peut être mainte-
nue avec seulement 20 à 25 % du flux artériel normal par accrois-
sement local de l’extraction en oxygène. En dessous de 40 mmHg
ou si le flux artériel chute en dessous de 30 ml/mn pour 100 g de
tissu, ce mécanisme est dépassé et l’ischémie intestinale s’installe,
avec passage vers un métabolisme anaérobie (3). L’étendue de
l’atteinte digestive est directement liée à la durée et à l’importance
de l’ischémie. La limite de temps pour laquelle les lésions sont
considérées comme définitives sera fonction de la rapidité d’instal-
lation de l’obstacle artériel et des possibilités de mise en jeu des
suppléances anastomotiques. Ainsi, cette période pendant laquelle
les lésions d’ischémie sont encore réversibles est particulièrement
courte pour les embolies. Des désordres de l’autorégulation
splanchnique expliquent que, même pour une pression de perfu-
sion normale de l’intestin, avec existence d’une circulation colla-
térale bien développée, des lésions ischémiques peuvent apparaître.
Les atteintes tissulaires intestinales surviennent à la fois au cours
de la phase ischémique et au cours de la reperfusion. Les effets
néfastes de la reperfusion peuvent alors dépasser ceux de l’isché-
mie et conduire à une défaillance multiviscérale avec atteinte pul-
monaire, hépatique et rénale. Des abcès hépatiques multiples ont
été rapportés après revascularisation de l’AMS. La reperfusion des
tissus ischémiés est associée à la libération de composés radica-
laires toxiques. Les radicaux libres engendrent une augmentation
de la perméabilité tissulaire, une activation des enzymes inflamma-
toires et des polynucléaires neutrophiles à l’origine d’une réponse
inflammatoire locale intense.
L’altération de la muqueuse intestinale va favoriser le passage de
bactéries, d’endotoxines et de différents facteurs tels que les enzymes
digestives depuis la lumière intestinale vers le système porte. L’as-
sociation d’une lésion digestive initiale compliquée secondairement
d’une atteinte infectieuse et/ou inflammatoire constitue un formi-
dable modèle de développement d’un syndrome de défaillance
multiviscérale décrit sous le terme de two-hit phenomenon (4).
L’IIA OCCLUSIVE : DIAGNOSTIC ET TRAITEMENT
Clinique et facteurs prédisposants
La phase précoce
La douleur abdominale est le signe le plus fréquent et le plus pré-
coce. Elle est brutale et sévère, souvent discordante avec l’examen
abdominal, sans signe d’irritation péritonéale. Dans les IIA par
embolie, le début des douleurs est brutal, et elles sont fortement
évocatrices du diagnostic lorsqu’il existe une embolie concomi-
tante (ischémie de membre, accident vasculaire cérébral).
Dans l’IIA par thrombose, le début des douleurs est plus pro-
gressif. Près de 50 % des patients se plaignent depuis plusieurs
mois de douleurs abdominales postprandiales précoces en rapport
avec une ischémie intestinale chronique non diagnostiquée. D’autre
part, 20 % des ischémies intestinales chroniques se révèlent sous une
forme trompeuse de cholécystite ischémique ou d’ulcères gastro-
duodénaux, souvent multiples, récidivants ou résistants au traite-
ment médical. La triade diagnostique de l’angor intestinal (douleur
postprandiale, amaigrissement, diarrhée) est complète dans moins
de 40 % des cas (5),mais doit être recherchée pour poser le dia-
gnostic au stade précoce d’ischémie intestinale chronique. On peut
noter la présence d’un souffle épigastrique ou la disparition d’un
souffle connu qui oriente vers la thrombose aiguë.
Il n’y a pas de signes généraux ; la tension et la température sont
normales.
C’est le contexte et le terrain de cette douleur qui doivent guider
vers un diagnostic précoce. Dans l’étude de Boley et al., les
patients à risque d’IIA étaient âgés de plus de 50 ans, avec une
insuffisance cardiaque, des troubles du rythme cardiaque, un
infarctus du myocarde récent, une hypovolémie ou un sepsis (6).
On a montré une ischémie mésentérique chez 18 % des patients
de plus de 65 ans et 70 % des patients opérés de pontage aorto-
bifémoral (7).
La phase tardive
Lorsque le diagnostic n’est pas fait au stade de lésions réversibles,
la clinique se modifie et c’est le classique tableau d’infarctus intes-
tinal : la douleur devient atroce et continue, on perçoit une défense
ou une contracture avec une matité des flancs (ascite hémorragique)
et un silence auscultatoire (silence sépulcral d’Ameline).
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005
152

Facteurs pronostiques
Le taux de mortalité varie en fonction de l’étiologie de l’isché-
mie intestinale. On peut classer par ordre décroissant de morta-
lité l’ischémie intestinale à vaisseaux perméables, l’ischémie
intestinale occlusive et, enfin, l’infarcissement veineux intestinal,
de meilleur pronostic. De façon générale, les patients jeunes, avec
une faible extension des lésions d’ischémie digestive et une his-
toire clinique courte ont une meilleure survie (8). Les lésions
d’ischémie intestinale sont en effet réversibles chez plus de
90 % des patients si les symptômes évoluaient depuis moins de
12 heures (9).
Les étiologies
Les causes thrombotiques sont essentiellement représentées par
l’athérome (le contexte est souvent évident : grand fumeur, artérite
des MI associée, etc.). Les causes emboliques sont surtout d’ori-
gine cardiaque (trouble du rythme, infarctus du myocarde, valvulo-
pathies) ; elles sont parfois aortiques (anévrisme, plaque d’athé-
rome, iatrogénie lors d’une aortographie, etc.).
Examens complémentaires
●
●
L’abdomen sans préparation est de réalisation quasi systéma-
tique dans une urgence abdominale. Il ne montre que des signes
non spécifiques ou très tardifs et ne sert en pratique qu’à éliminer
d’autres causes de douleur abdominale aiguë, comme une perfora-
tion d’ulcère duodénal.
●
●
La tomodensitométrie abdominopelvienne pourrait devenir l’exa-
men de référence. Les derniers appareils “multibarette” ont rem-
placé peu à peu les scanners d’ancienne génération. Des obstruc-
tions et des sténoses vasculaires ainsi que des anomalies des parois
digestives peuvent être observées. L’IRM permet d’ajouter une
information fonctionnelle par l’utilisation de séquences sensibles
à la saturation en oxygène de l’hémoglobine dans la veine mésen-
térique supérieure. Cependant, la supériorité diagnostique de ces
scanners de dernière génération doit encore être confirmée.
●
●
L’artériographie cœliomé-
sentérique avec clichés d’aorto-
graphie de profil reste l’examen
de référence (figure 1). Elle per-
met le diagnostic des ischémies
non occlusives et peut être la
première étape thérapeutique en
l’absence de signe d’irritation
péritonéale. C’est cependant un
examen invasif et ses indications
restent controversées (10). L’ar-
tériographie ne doit pas retarder
la prise en charge chirurgicale et
on a recommandé la laparotomie
exploratrice en cas de forte sus-
picion clinique d’IIA (11).
●
●
L’échodoppler couleur des
vaisseaux mésentériques est un
mauvais examen en urgence. La
distension intestinale en gêne
l’interprétation.
●
●
La recherche de marqueurs biologiques comme l’amylase, le pH
artériel, la leucocytose, les LDH ou les CPK-BB (spécificité de
100 % pour des valeurs supérieures à 20 ng.ml-1) est habituelle,
mais leur élévation témoigne le plus souvent d’une ischémie évo-
luée au stade de lésions irréversibles. Il a été montré que le dosage
de l’isomère dextrogyre du lactate (d-lactate) pouvait être utilisé
comme un critère biologique intéressant de l’IIA (sensibilité de
90 % et spécificité de 87 % pour une concentration sanguine supé-
rieure à 20 ng.ml-1). Les D-dimères ont été rapportés comme étant
un marqueur précoce de l’IIA. Récemment, la sous-unité de la
S-glutathion transférase (-GST) s’est révélée être un meilleur mar-
queur de l’IIA que les tests biologiques standard. Actuellement,
l’expérience concernant ces marqueurs biologiques reste limitée.
Traitement
La réanimation
À la phase initiale, il faut maintenir une hémodynamique stable et
corriger un éventuel troisième secteur. Il faut corriger les troubles
hydro-électrolytiques et l’acidose métabolique, installer une aspi-
ration nasogastrique continue pour lutter contre la distension
abdominale et instaurer une antibiothérapie prophylactique péri-
opératoire ou curative en présence d’un sepsis à point de départ
abdominal. Enfin, dans tous les cas, un traitement cherchant à
prévenir les conséquences de la reperfusion (antiradicalaires,
vasodilatateurs, spasmolytiques) peut être associé. Cependant, ce
type de traitement n’a pas, à l’heure actuelle, fait la preuve de son
efficacité. L’anticoagulation est discutée. Elle prévient l’exten-
sion de la thrombose et de la CIVD, mais peut être à l’origine d’une
hémorragie digestive grave.
La chirurgie
Le patient est à opérer dès que son état le permet. L’intervention
est réalisée par laparotomie médiane. La première étape consiste
à apprécier l’étendue de l’ischémie intestinale. Une atteinte isché-
mique d’autres viscères, comme le foie et la vésicule biliaire, est
également recherchée (figure 2). Au terme de cette exploration,
différentes situations sont envisageables :
–Infarctus constitué (lésions irréversibles) : en présence d’un
infarctus étendu à l’ensemble de l’intestin grêle, il n’y a aucune
survie possible et l’intervention est limitée à la seule exploration
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005 153
Figure 1. Aspect de “désert mésen-
térique” sur l’aortographie de profil.
On remarque une sténose à l’origine
du tronc cœliaque. Figure 2. Cholécystite ischémique et plage de nécrose hépatique.

DOSSIER THÉMATIQUE
(figure 3). Si l’atteinte du grêle
est limitée, la résection intesti-
nale est effectuée sans geste
artériel.
–Ischémie sans infarctus cons-
titué (lésions réversibles) : une
revascularisation digestive est
alors pratiquée avant tout geste
de résection intestinale (figure 4).
La restauration d’une vascula-
risation mésentérique permet
ensuite de déterminer les zones
de nécroses digestives irréver-
sibles. Pour les formes embo-
liques, l’embolectomie par sonde
à ballonnet de Fogarty est faite
par artériotomie de l’artère
mésentérique supérieure. Dans
les ischémies par thrombose, la
revascularisation est réalisée par pontage aorto- ou iliomésentérique.
La discussion reste ouverte entre les partisans de la revascularisa-
tion isolée de l’AMS et ceux qui prônent une double revasculari-
sation hépatique et mésentérique supérieure. Il n’y a pas de preuve
scientifique pour recommander une revascularisation antérograde
(pontage à partir de l’aorte cœliaque) ou rétrograde (pontage à par-
tir de l’axe iliaque ou de l’aorte sous-rénale). De la même façon,
aucun matériau (PTFE ou veine) n’a fait la preuve de sa supériorité.
Un lavage peropératoire des vaisseaux mésentériques peut mini-
miser les conséquences de la reperfusion artérielle.
Évaluation de la viabilité intestinale : après la revascularisation,
les segments jugés non viables sont réséqués. On peut s’aider en
peropératoire d’un test à la fluorescéine sous lampe de Wood et/ou
d’un doppler pour juger de la viabilité du grêle. Les zones vouées
à la nécrose ne se colorent pas sous lampe de Wood. Cette méthode
a été plus fiable que l’évaluation clinique (couleur, battements
mésentériques, péristaltisme) dans l’évaluation de la viabilité intes-
tinale, mais nécessite une expérience importante pour interpréter
les résultats.
La réalisation de stomies temporaires est préférée s’il existe une
péritonite ou si la viabilité du grêle conservé est douteuse. Un intes-
tin conservé de viabilité douteuse justifie une réintervention systé-
matique (second look) à 24 ou 48 heures. Cependant, cette laparo-
tomie de contrôle est grevée d’une mortalité propre et pourrait être
remplacée avantageusement par une exploration laparoscopique.
Traitements endoluminaux
Ils ne peuvent s’envisager qu’en l’absence de signes d’irritation
péritonéale. L’angioplastie endoluminale percutanée avec thrombo-
aspiration a été proposée (NP 4). Elle serait indiquée dans les sté-
noses serrées juxta-ostiales de l’AMS ou comme test thérapeutique
devant une symptomatologie atypique.
La thrombolyse intra-artérielle semble efficace si elle est débutée
dans les 12 heures qui suivent l’apparition des douleurs, en cas
d’obstruction partielle du tronc de l’AMS ou des branches distales
de l’AMS (12-15). L’expérience est cependant limitée, et la fibrino-
lyse expose au risque hémorragique.
L’IIA NON OCCLUSIVE
C’est la forme la plus grave des IIA, avec un taux de mortalité entre
70 et 100 %. Elle représente 25 à 60 % des infarctus intestinaux.
Elle est particulièrement fréquente chez les opérés cardiaques et
les patients hémodialysés. Neuf à 20 % des décès en hémodialyse
ont été rapportés à une IIA non occlusive (10). Enfin, l’existence
d’une colite ischémique associée est un argument diagnostique
supplémentaire. En effet, la colite ischémique a été un facteur de
comorbidité fréquent de l’IIA non occlusive, avec un mécanisme
physiopathologique similaire (10).
Clinique
Le début progressif des douleurs ainsi que la symptomatologie
peu spécifique à type de météorisme et de vomissements retardent
souvent le diagnostic. Cette douleur peut manquer chez 15 à
20 % des malades (16). Il faut être attentif aux chocs hémorra-
giques ou septiques dans les jours précédents.
On a incriminé l’angiotensine II et la vasopressine, produites par
le rein et la glande pituitaire, dans la vasoconstriction splanchnique
permanente à l’origine de l’IIA non occlusive (17, 18).
Les étiologies
Ce sont tous les états de choc (cardiogéniques, septiques, hypovolé-
miques), certains médicaments (corticoïdes, digitaliques, diurétiques,
etc.), les manifestations allergiques, certaines bactéries (Clostridium).
Examen complémentaire et traitement
L’artériographie cœliomésentérique est importante pour le dia-
gnostic et afin de débuter le traitement par l’injection de papavé-
rine dans le cathéter intra-artériel. La laparotomie en période de
décompensation cardiocirculatoire est formellement contre-indi-
quée. Il faut avant tout rétablir une hémodynamique stable. L’inter-
vention est programmée de principe à 12 ou 24 heures pour vérifier
l’évolution des lésions. Les vasodilatateurs par voie générale et intra-
artérielle sont à poursuivre pendant et après la chirurgie.
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005
154
Figure 3. Infarctus intestinal constitué. L’ensemble du grêle est nécrosé
de façon irréversible.
Figure 4. Lésions ischémiques
réversibles du grêle.

L’INFARCISSEMENT MÉSENTÉRIQUE VEINEUX (IMV)
Clinique
Le début de la symptomatologie douloureuse est progressif. L’in-
terrogatoire peut retrouver une douleur abdominale évoluant par
crises depuis quelques jours ou quelques semaines. Il peut s’asso-
cier des hémorragies digestives (souvent occultes). La présentation
clinique peut être plus bruyante, avec un choc septique inaugural.
On a décrit une forme aiguë et chronique en fonction de la durée
d’évolution. On parle d’IMV aigu si la symptomatologie évolue
depuis moins de 4 semaines (5 à 15 % des patients). Seuls 9 % des
patients se plaignent de douleurs évoluant depuis moins de
24 heures (19). Les formes chroniques sont de meilleur pronostic
que les formes aiguës.
Les étiologies
L’IMV est classé comme IMV primaire (spontané ou idiopathique)
ou secondaire. Les causes d’IMV secondaires sont : les états
d’hypercoagulabilité (déficit en protéine S, C, antithrombine III,
mutation du facteur V Leiden, thrombocytémie essentielle, syn-
drome myéloprolifératif, etc.), les foyers d’inflammation abdo-
minale (sigmoïdite, pancréatite, péritonite, etc.), la cirrhose et
l’hypertension portale, la grossesse, les cancers, les traumatismes
abdominaux, les splénomégalies et, en postopératoire d’une splé-
nectomie, les maladies inflammatoires du tube digestif (Crohn,
RCH).
Examens complémentaires
La tomodensitométrie abdominale avec injection est l’examen
complémentaire de choix, montrant une image en cocarde dans l’axe
veineux mésentéricoporte, des anses grêles épaissies et une ascite.
La valeur diagnostique des D-dimères, très utile dans le diagnostic
des phlébites profondes du membre inférieur et des embolies pul-
monaires, reste controversée (20) (NP 4).
Traitement
En l’absence de signe d’irritation péritonéale, une anticoagulation
doit être débutée à dose efficace par héparine pour une durée de
7à 10 jours, relayée par les antivitamines K oraux pendant 3 à
6mois (21) (NP 3). La thrombolyse a également été proposée, par
l’AMS, la veine jugulaire interne ou par voie trans-hépatique.
Lors de la découverte d’une thrombose mésentéricoporte sur une
tomodensitométrie abdominale systématique, la décision de trai-
ter le patient pendant 3 à 6 mois par antivitamines K ou de ne pas
le traiter est à évaluer en fonction du contexte. Il n’y a pas de don-
née scientifique pour recommander l’une ou l’autre attitude.
CONCLUSION
L’IIA regroupe un ensemble de pathologies différentes au pronos-
tic variable. La mortalité reste importante. Les progrès viendront
d’une meilleure connaissance des signes cliniques de l’angor
intestinal, et donc du dépistage précoce des ischémies digestives à
un stade où les revascularisations sont encore possibles et efficaces.
Encore aujourd’hui, le délai est de près d’un an pour parvenir au
diagnostic d’angor mésentérique. Il faut savoir évoquer l’infar-
cissement veineux intestinal devant une douleur abdominale sub-
aiguë dans un contexte d’hypercoagulabilité. Nous sommes encore
en attente d’un marqueur biologique fiable de l’ischémie sans
nécrose. ■
Mots-clés : Douleur abdominale - Artériographie cœliomésen-
térique - Tomodensitométrie abdominale - Pontage aorto-
mésentérique.
Keywords: Abdominal pain - Angiography - CTscan - Aorto-mesenteric
by-pass.
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Endean ED, Barnes SL, Kwolek CJ et al. Surgical management of thrombotic
acute intestinal ischemia. Ann Surg 2001;233:801-8.
2. Mikkelsen WP. Intestinal angina: its surgical significance. Am J Surg 1957;
94(2):262-7.
3. Wilcox MG, Howard TJ, Plaskon LA et al. Current theories of pathogenesis
and treatment of nonocclusive mesenteric ischemia. Dig Dis Sci 1995;40(4):
709-16.
4. Deitch EA. Multiple organ failure. Pathophysiology and potential future the-
rapy. Ann Surg 1992;216:117-34.
5. Zerbib P, Lebuffe G, Massouille D et al. Results of revascularization in chronic
intestinal ischemia. Eur J Gastroenterol 2005. Soumis.
6. Boley SJ, Sprayregen S, Veith FJ, Siegelman SS. An aggressive roentgenologic
and surgical approach to acute mesenteric ischemia. Surg Ann 1973;5:355-78.
7. Roobottom CA, Dubbins PA. Significant disease of the celiac and superior
mesenteric arteries in asymptomatic patients: predictive value of Doppler sono-
graphy. Am J Roentgenol 1993;161(5):985-8.
8. Wilson C, Gupta R, Gilmour DG, Imrie CW. Acute superior mesenteric
ischaemia. Br J Surg 1987;74(4):279-81.
9. Vellar ID, Doyle JC. Acute mesenteric ischaemia. Aust N Z J Surg 1977;
47(1):54-61.
10. Yasuhara H. Acute mesenteric ischemia: the challenge of gastroenterology.
Surg Today 2005;35(3):185-95.
11. Bradbury AW, Brittenden J, McBride K, Ruckley CV. Mesenteric ischaemia:
a multidisciplinary approach. Br J Surg 1995;82(11):1446-59.
12. Nathan N, Wintringer P, Bregeon Y et al. Intra-arterial thrombolysis of acute
mesenteric ischemia. Ann Fr Anesth Reanim 1995;14(1):33-6.
13. Badiola CM, Scoppetta DJ. Rapid revascularization of an embolic superior
mesenteric artery occlusion using pulse-spray pharmacomechanical thrombolysis
with urokinase. Am J Roentgenol 1997;169(1):55-7.
14. Regan F, Karlstad RR, Magnuson TH. Minimally invasive management of
acute superior mesenteric artery occlusion: combined urokinase and laparoscopic
therapy. Am J Gastroenterol 1996;91(5):1019-21.
15. Simo G, Echenagusia AJ, Camunez F et al. Superior mesenteric arterial
embolism: local fibrinolytic treatment with urokinase. Radiology 1997;204(3):
775-9.
16. Zerbib P, Chambon JP, Alarcon B, Quandalle P. Acute intestinal ischemia.
Hepatogastroenterology 1998;5(4):283-90.
17. Bailey RW, Bulkley GB, Hamilton SR et al. Protection of the small intestine
from nonocclusive mesenteric ischemic injury due to cardiogenic shock. Am J Surg
1987;153(1):108-16.
18. McNeill JR, Stark RD, Greenway CV. Intestinal vasoconstriction after hemor-
rhage: roles of vasopressin and angiotensin. Am J Physiol 1970;219(5):1342-7.
19. Rhee RY, Gloviczki P. Mesenteric venous thrombosis. Surg Clin North Am
1997;77(2):327-38.
20. Brill-Edwards P, Lee A. D-dimer testing in the diagnosis of acute venous
thromboembolism. Thromb Haemost 1999;82(2):688-94.
21. Morasch MD, Ebaugh JL, Chiou AC et al. Mesenteric venous thrombosis:
a changing clinical entity. J Vasc Surg 2001;34(4):680-4.
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005 155
1
/
5
100%