Word 2007

Chapitre 14 : Transformations en chimie organique
La chimie organique est une branche de la chimie concernant l'étude scientifique et la transformation de molécules
d'origine pétrolière ou vivante contenant principalement du carbone, de l'hydrogène avec de l'oxygène, et de l'azote. Elle
étudie en particulier leur structure, leurs propriétés, leurs caractéristiques, leur composition, leurs réactions et leur
préparation (par synthèse ou autres moyens).
Source : Wikipedia
1. Aspect macroscopique
1.1. Modification de la chaîne carbonée d'une molécule
Les coupes issues de la distillation fractionnée des pétroles conduisent en général, à des composés qui ne sont pas
directement utilisables ou dont les propriétés sont inadaptées à la demande des consommateurs (industries, grand
public (essences)...). On est donc amené à modifier la chaîne carbonée des hydrocarbures issus de cette distillation
fractionnée.
Exemples d’applications :
- Améliorer la qualité des essences en augmentant l'indice d'octane(
1
) ;
- Produire des alcènes (hydrocarbures dits insaturés) à partir d'hydrocarbures saturés. Ces alcènes, beaucoup
plus réactifs que les hydrocarbures saturés, sont des intermédiaires de synthèse très importants pour
l'industrie.
1.1.1. Fragmentation d'une chaîne carbonée
Le craquage catalytique
L'opération dite de craquage catalytique, brevetée par Eugène Houdry en 1928, permet de casser à l'aide d'un
catalyseur les grosses molécules d'hydrocarbures saturés à longues chaînes par l'agitation thermique. On obtient des
molécules plus petites à chaînes plus courtes, généralement des alcanes et des alcènes. Elle s'effectue à 500°C à
pression atmosphérique.
Des catalyseurs à base de platine-molybdène sont utilisés pour favoriser et accélérer cette réaction de craquage.
Les produits obtenus sont des molécules plus légères telles que :
- Des gaz de chauffe ;
- De la matière première, par exemple l'éthylène pour l’industrie chimique ou autre ;
- Des essences, qui ne sont pas directement utilisables sans subir un reformage catalytique (voir plus loin).
Le vapocraquage (ou hydrocraquage)
Il s’agit d’un craquage permettant d'obtenir des alcènes en présence de vapeur d'eau. Cette opération est effectuée
à 800°C et à pression atmosphérique.
Remarque : Ces alcènes sont principalement utilisés comme matière première dans l'industrie des matières
plastiques (polyéthylène, polypropylène, etc.).
Exemple :
CH2CH2
2
CH3CH2CH2CH3+H2
(g)
(g) (g)
1.1.2. Modification de la structure de la chaîne carbonée
Le reformage catalytique
Cette opération permet de modifier la structure d'une chaîne carbonée. Cette réaction s'effectue à température
et pression élevée.
1
Indice d'octane (IO) : nombre caractérisant le
pouvoir antidétonant d'un carburant.

Application :
- Essences obtenues par craquage catalytique : le reformage catalytique permet d'obtenir des dérivés
benzéniques et du dihydrogène.
L'isomérisation (ou ramification du squelette carboné)
Cette opération permet de transformer un alcane à chaine linéaire (hydrocarbure) en son isomère de constitution
ramifiée, à température modérée (120°C à 200°C).
Exemples :
La réaction d'isomérisation de l'hexane
en 2,2-diméthylbutane
La réaction d'isomérisation de l'octane
(IO = 0) en 2,2,4-triméthylpentane
(IO = 100)
La cyclisation
Elle consiste à transformer un alcane linéaire en cyclane (alcane à chaîne fermée ou cyclique) souvent ramifiés et en
dihydrogène dans des conditions voisines des précédentes. Cette transformation n'est possible que pour des alcanes
possédant au moins cinq atomes de carbone.
Exemples :
La réaction de cyclisation de l'hexane
En méthylcyclopentane
La réaction de cyclisation de l'hexane
en cyclohexane
La déshydrocyclisation
Cette opération permet d'obtenir des dérivés benzéniques et du dihydrogène en réalisant la transformation
précédente à une température plus élevée (voisine de 500°C) et en présence d'un catalyseur (exemple le platine Pt).
Elle s'accompagne alors d'une déshydrogénation (élimination d'une molécule de dihydrogène) et conduit à
l'apparition d'un cycle benzénique.
Exemples :
Réaction de déshydrocyclisation
de l'hexane en benzène
Réaction de déshydrocyclisation de
l'heptane (IO = 0) en méthylbenzène
1.1.3. Allongement de la chaîne carbonée
L'alkylation
Opération qui consiste à substituer (remplacer) un atome d'hydrogène d'une chaîne carbonée par un groupe alkyle.
On allonge la chaine d'un alcane en le faisant réagir avec un alcène (opération inverse du craquage). Son intérêt est
de produire des espèces chimiques à fort indice d'octane.

Exemple :
La réaction entre le méthylpropène et le méthylpropane
donne du 2,2,4-triméthylpentane
C4H8(g) + C4H10(g) C8H18(g)
La polymérisation par polyaddition (ajout de plusieurs molécules généralement identique)
Cette opération permet de rallonger la chaîne carbonée principale en réalisant une addition répétée d'un très grand
nombre de molécules insaturées appelées monomères. Elle conduit à une macromolécule appelée polymère.
Exemple : réaction de polymérisation de n molécules de monomère styrène
n est appelé indice (ou degré) de polymérisation et le groupe
—CH2—CH(Ph)— est appelé motif du polymère
Quelques exemples de polymères et leurs principales applications :
1.2. Modification du groupe caractéristique
1.2.1. Espèces chimiques polyfonctionnelles
Définition :
Une espèce chimique est dite polyfonctionnelle si elle appartient à plusieurs classes fonctionnelles ou possède
plusieurs groupes caractéristiques identiques.
Le nom d'une espèce chimique organique s'organise en trois parties :
Un radical : il nous informe sur la chaîne carbonée principale ;
Un suffixe : il permet d'identifier le groupe caractéristique par rapport auquel la ou les chaînes sont
numérotées. Il permet d'identifier la présence et la position du groupe caractéristique prioritaire (fonction) ;
Le suffixe d’insaturation (-èn), précédé du numéro de position, est prioritaire sur les ramifications lors de la
numérotation de la chaîne principale. Si la molécule ne présente pas d’insaturation, le suffixe d’insaturation
n’apparaît pas ;
Un ou plusieurs préfixes : ils permettent d'identifier la présence et la position des autres groupes
caractéristiques non prioritaires ou les groupes « alkyle » de la molécule. ils sont précédés des numéros de
position, les plus petits possibles.

En résumé :
Ramifications + Nom de la chaîne principale + suffixe d’insaturation + fonction
ou
Préfixe + radical + insaturation + suffixe
Terminaisons et préfixes :
Groupe caractéristique
Fonction
Terminaison
Préfixe
Alcène
C C
-ène
Hydroxyle
OH
Alcool
-ol
hydroxy
Carbonyle
Aldéhyde
-al
formyl
Carbonyle
Cétone
-one
oxo
Carboxyle
Acide carboxylique
Acide -oïque
Ester
Ester
-oate de -yle
Amine
Amine
-amine
amino
Amide
Amide
-amide
Nitrile
‒ C N
Nitrile
-nitrile
cyano
Exemple :
OH
O
O
Acide 3-oxobutanoïque
1.2.2. Modification du groupe caractéristique
Une réaction chimique peut également modifier le groupe caractéristique de l'espèce chimique.
Exemples :
- La réaction d'oxydation de l'éthanol en acide éthanoïque sous l'action du dioxygène :
CH3‒CH2‒OH + O2 CH3‒COOH + H2O
Le groupe caractéristique hydroxyle (alcool) est transformé en groupe caractéristique carboxyle (acide
carboxylique).
H

- La réaction d'oxydation ménagée d’un alcool par les ions permanganate (1ère S) :
R C O
H
H H
RC
HO
1.3. Les catégories de réaction en chimie organique
1.3.1. Substitution
Définition :
Une réaction de substitution est une réaction chimique au cours de laquelle un atome ou groupe d'atomes est
remplacé par un autre atome ou groupe d'atomes.
Exemple :
1.3.2. Addition
Définition :
Une réaction d’addition est une réaction chimique au cours de laquelle un atome ou un groupe d'atomes vient se
fixer sur des atomes initialement liés par une double ou une triple liaison.
Exemples :
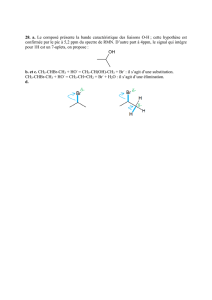
1.3.3. Élimination
Définition :
Une réaction d’élimination est une réaction chimique au cours de laquelle deux atomes ou groupes d'atomes voisins
sont retirés d'une molécule. Entre les 2 atomes porteurs de ces groupes d'atomes se forme une double ou une triple
liaison.
oxydation
ménagée
Alcool primaire
Aldéhyde
Oxydation ménagée
(oxydant en défaut)
Acide Carboxylique
Oxydation ménagée
(oxydant en excès)
Une réaction d’addition
peut aussi s’accompagner
de l’ouverture d’un cycle
d’atomes
 6
6
 7
7
 8
8
 9
9
1
/
9
100%