Fascicule de Biochimie pour l`Armature du 09 décembre 2013 – By

Conformément à la loi du 11 mars 1957, aucune reproduction, même partielle ne pourra être faite sans accord préalable de l’ATMC.
Ces exercices sont rédigés par des étudiants bénévoles, et n’engagent ni la responsabilité de la faculté de Médecine, ni celle des
enseignants.
1
Fascicule de Biochimie pour l’Armature du 09
décembre 2013 – By Barney et Mac Fly
Sommaire :
- Exercice 1 : Séquence peptidique en acides aminés n°1 (page 2)
- Exercice 2 : Séquence peptidique en acides aminés n°2 (page 2)
- Exercice 3 : Electrophorèse et PKA (page 3)
- Exercice 4 : Oligopeptides et PKA (page 3)
- Exercice 5 : Enzymologie et cinétique n°1 (page 4)
- Exercice 6 : Enzymologie et cinétique n°2 (page 4)
- Exercice 7 : Glycogène et ATP (page 5)
- Exercice 8 : Voies métaboliques n°1 (page 6)
- Exercice 9 : Voies métaboliques n°2 (page 7)
- Exercice 10 : Dégradation des acides gras et bilan ATP (page 8)
- Exercice 11 : Dégradation des acides gras, bilan ATP et inhibiteurs (page
8)
- Exercice 12 : Réaction d’oxydoréduction (page 8)
- Petits QCMs en plus concernant les cours du Professeur Allouche. (page 9
à 11)
Ces exercices seront abordés lors de l’armature du 09 décembre, avec une
correction détaillée, des rappels de cours (dont un retour sur l’effet découplant de
la chaîne respiratoire) et des explications claires.
Bon courage

Conformément à la loi du 11 mars 1957, aucune reproduction, même partielle ne pourra être faite sans accord préalable de l’ATMC.
Ces exercices sont rédigés par des étudiants bénévoles, et n’engagent ni la responsabilité de la faculté de Médecine, ni celle des
enseignants.
2
Exercice 1 : Séquence peptidique en acides aminés n°1
Un pentapeptide est composé de 5 AA de nature différente. Dans un premier temps, on
le met en contact avec une aminopeptidase ce qui libère un résidu arginine et un tétrapeptide.
Dans un deuxième temps, on ajoute une carboxypeptidase, on obtient un AA sans
carbone asymétrique plus un tripeptide.
Ensuite, on ajoute de la trypsine ce qui libère un dipeptide ainsi qu’un acide aminé dont
la longueur d’absorbance maximale est de 280nm. Enfin, on mesure l’absorbance à différentes
longueur d’onde du dipeptide restant, et cette dernière est maximale à 260nm.
Déterminer la ou les composition(s) possible(s) de ce peptide.
Exercice 2 : Séquence peptidique en acides aminés n°2
On est en présence d’un décapeptide composé de 7 AA différents. On lui fait subir différentes
réactions pour connaitre sa composition :
- On ajoute du β-mercaptoéthanol ce qui scinde le peptide en un hexapeptide A et en un
tétrapeptide B
- L’addition de bromure de cyanogène coupe l’hexapeptide A en deux tripeptides C pour
la partie aminoterminale et D pour la partie carboxyterminale. De plus suite à la réaction
du bromure de cyanogène, l’AA à l’extrémité C-term du peptide D se transforme en
Homosérine
- Si on ajoutait de la chymotrypsine, l’homosérine de l’extrémité C-term du peptide D et
l’alanine en position C-term du peptide B seraient libérés
- On mesure l’absorbance maximale du peptide B et on trouve Amax = 260nm
- Si on ajoutait de la trypsine l’AA à l’extrémité C-term du peptide C serait libéré
- Le peptide C contient l’AA précurseur du monoxyde d’azote (NO)
- Grâce à l’hydrolyse acide on identifie un résidu Cystéine ainsi qu’un AA avec une
fonction alcool dans le peptide D
- Une aminopeptidase mettrait en évidence un résidu glutamate sur le peptide C et un AA
excitateur du SNC sur le peptide B
Quelle est la composition possible pour ce peptide ?

Conformément à la loi du 11 mars 1957, aucune reproduction, même partielle ne pourra être faite sans accord préalable de l’ATMC.
Ces exercices sont rédigés par des étudiants bénévoles, et n’engagent ni la responsabilité de la faculté de Médecine, ni celle des
enseignants.
3
Exercice 3 : Electrophorèse et PKA
Lors d’une électrophorèse, on dispose de 4 acides amines
Ces 4 acides aminés sont : Val, Glu, Lys et Phe
On souhaite tester l’électrophorèse à pH = 1 ; pH = 4 ; pH = 7 ; pH = 12.
On donne :
Val : pKa1 : 2,39 PKa2 : 9,74
Glu : pKa1 : 2,10 PKa2 : 9,47 PKa3 : 4,07
Lys : pKa1 : 2,16 pKa2 : 9,06 Pka3 : 10,54
Phe : pKa1 : 2,20 pKa2 : 9,31
Indiquez le comportement le comportement de chaque acide amine (dire s’ils se
comportent comme des anions/des cations, sens de migration) en fonction des différentes
valeurs de pH.
Exercice 4 : Oligopeptides et électrophorèse
On a à notre disposition, 3 oligopeptides, dont on veut étudier le déplacement lors d’une
électrophorèse.
1) Gly-Lys-Arg-Asp-Iso
2) Arg-Val-Leu-Tyr-Glu
3) Ala-Glu-Lys-Asp-Glu
Question 1 : Quelle est la charge globale de chaque peptide pour pH = 1 ? pH = 6 ? pH = 11 ?
Question 2 : Y a-t-il une valeur de pH pour laquelle les trois peptides sont bien séparés ?

Conformément à la loi du 11 mars 1957, aucune reproduction, même partielle ne pourra être faite sans accord préalable de l’ATMC.
Ces exercices sont rédigés par des étudiants bénévoles, et n’engagent ni la responsabilité de la faculté de Médecine, ni celle des
enseignants.
4
Exercice 5 : Enzymologie et cinétique n°1
On mesure l’activité d’une enzyme en absence et en présence d’inhibiteur en fonction de la
concentration en substrat :
[S] x 10-5M
Vitesse (μmoles/min)
Sans inhibiteur
Vitesse (μmoles/min)
Avec inhibiteur
5
41.67
25.64
1.67
27.03
16.39
0.67
14.93
9.09
0.33
8.62
5.24
- Comment appelle-t-on ce type de cinétique ?
- Déterminez Km et Vmax avec et sans l’inhibiteur
- De quel type d’inhibition s’agit-il ?
Exercice 6 : Enzymologie et cinétique n°2
On veut étudier la cinétique d’une enzyme allostérique, l’aspartate-transcarbamylase.
[S] x 10-6M
1/V (1/(μmoles/min))
40
52.4
45
50.2
50
43.2
60
32.1
70
15.0
Grace à un diagramme de Lineweaver Burk, déterminez la Km et la Vmax

Conformément à la loi du 11 mars 1957, aucune reproduction, même partielle ne pourra être faite sans accord préalable de l’ATMC.
Ces exercices sont rédigés par des étudiants bénévoles, et n’engagent ni la responsabilité de la faculté de Médecine, ni celle des
enseignants.
5
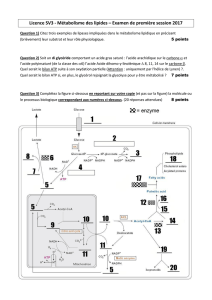
Exercice 7 : Glycogène et ATP
Voici une molécule de glycogène, qui contient 38 hexoses et une glycogénine :
1) Lors de la dégradation complète par la glycogène phosphorylase et l’enzyme débranchante,
combien de molécules de glucose vont être libérés ? De glucose 1P ?
2) Combien d’ATP vont être produits si toutes les molécules libérées lors de cette
glycogénolyse complète subissent la glycolyse ?
3) En mode aérobie, quel sera le bilan en ATP de la dégradation complète du glycogène :
A) Si toutes les molécules de glucose empruntent la navette malate/aspartate ?
B) Si les molécules de glucose empruntent la navette glycérol phosphate ?
4) Même questions pour le mode anaérobie
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%