Exercice 1 : 7 points Exercice 2 : 8 points Vendredi 15/02/2012

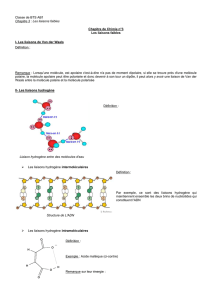
!"#$%&%#'(')'*'+,&-./'
0,%12#-.'()'01'+31.,-&12'45-/'36#/+5%#'7''065+$8/'999:%-5:%5'
!
"#$!%&'&()*#+($!*,#(-.&/#0*(12+#$!3!()41.51$.*.6#$7!.+!89:7!$.'*!&%)/#-#'*!)66#/&$!4#$!61/#$!'+0/&)1(#$;!</$!$.'*!
#-6/.=&$!4)'$!/#$!-1/1#+>!6)(*10+/1?(#-#'*!1$./&$!)/1-#'*)'*!4#$!$)*#//1*#$!.+!0#(*)1'$!6,)(#$!4+!'.(4!4#!/)!8+$$1#;!
@1'$1!/)!$.'4#!A)$$1'1!/)'0&#!#'!BCCD!0.'*#')1*!;<='4#'+31.,-&12'>?;7!2+1!6(.4+1$)1*!+'#!&'#(%1#!*,#(-12+#!4#!@A@'<B'
%C5D1#'/#%,-4#7!0.'E#(*1#!#'!&/#0*(101*&!6)(!4#$!*,#(-.0.+6/#$;!")!-1$$1.'!)!$.+/#E&!
+'#!0#(*)1'#!0.'*(.E#($#;!F'!#GG#*!0#(*)1'$!$#!$.'*!1'2+1&*&$!4+!(1$2+#!4#!(#H#*!4+!
6/+*.'1+-!IJK!()41.)0*1G!4)'$!/L)*-.$6,?(#!#'!0)$!4L&0,#0!4+!/)'0#-#'*!4#!/)!G+$&#!
#-6.(*)'*!/)!$.'4#;!A#**#!6.$$1M1/1*&!#$*!0#(*#$!M1#'!(&#//#!-)1$!#//#!4#-#+(#!*(?$!
G)1M/#!6+1$2+#!/#$!89:!$.'*!0.'N+$!6.+(!$+66.(*#(!/#!(#*.+(!4)'$!/L)*-.$6,?(#!#*!
(&$1$*#(!3!+'!1-6)0*!3!%()'4#!E1*#$$#;!F'!BCDO7!/.($!4#!/)!-1$$1.'!1'*#((.-6+#!
@6.//.!BJ7!/#!-.4+/#!/+')1(#!2+1!)E)1*!6#(-1$!)+>!)$*(.')+*#$!4#!(#$*#(!#'!E1#!)!&*&!
&H#0*&7!6+1$!1/!$L#$*!4&$1'*&%(&!#'!(#'*()'*!4)'$!/L)*-.$6,?(#;!A#!-.4+/#!0.-6.(*)1*!
+'!89:!2+1!4#E)1*!$#(E1(!3!)/1-#'*#(!+'!M/.0!#>6&(1-#'*)/!/+')1(#;!"#!%&'&()*#+(!#$*!
*.-M&!4)'$!/#!$+4!4#!/L.0&)'!6)01G12+#!#*!)!0.+/&7!-)1$!1/!'L)!6)$!$+M1!4#!4.--)%#$!#*!
'L)!/1M&(&!)+0+'!()=.''#-#'*;P!
!
0,%12#-.'>')'0,--E#/''
• A&/&(1*&!4#!/)!/+-1?(#!4)'$!/#!E14#!Q!0RJ7OO;BOK!-;$5B!
• S'1*&!4T&'#(%1#!B!U#VRB7WO;BO5BJ!X!Y!!
• S'1*&!4#!-)$$#!)*.-12+#!Q!B+RB7WW;BO5ID!Z%!
• F>*()1*!4#!/)!0/)$$1G10)*1.'!
6&(1.412+#!Q!
!
'
!
F1#/.&,-/')''
B5!S'!'.=)+!4#!6/+*.'1+-!IJK!$#!4&$1'*?%(#!#'!/1M&()'*!+'!'.=)+!4T[&/1+-;!!
); \#!2+#/!*=6#!4#!(&)0*1.'!'+0/&)1(#!$T)%1*51/!]!
M; F$*!0#!+'#!(&)0*1.'!$6.'*)'&#!.+!6(.E.2+&#!]!
0; F0(1(#!/T&2+)*1.';!
I5!"#!6/+*.'1+-!IJK!3!+'#!-)$$#!4#!IJK7O^CW!+7!/L+()'1+-!4#!IJ^7O^BO!+!#*!/L,&/1+-!4#!^7OOB_!+;!
); A)/0+/#(!/)!E)(1)*1.'!4#!-)$$#!#'!Z1/.%()--#!/.($!4#!/)!(&)0*1.';!
M; F'!4&4+1(#!/)!E)/#+(!4#!/L&'#(%1#!/1M&(&#!#'!X!#*!#'!U#V;!
0; A.-M1#'!G)+*51/!4#!4&$1'*&%()*1.'!6.+(!/1M&(#(!^7^!ZX!#'!+'#!$#0.'4#!]!
4; F'!4&4+1(#!/)!E)/#+(!4#!/L)0*1E1*&!4#!/)!$.+(0#!#'!6/+*.'1+-!4#!/)!$.'4#!A)$$1'1!/.($!4#!$.'!/)'0#-#'*;!
!
!"#$%&%#'>')';'+,&-./! !
'
0,%12#-.'(')'G,31.&,-'+,1$'%&$%1&./'&-.E=$E/:'
"#$!$./+*1.'$!4#!0,/.(+(#!4#!G#(!`<<<a!$.'*!$.+E#'*!+*1/1$&#$!6.+(!/T)**)2+#!4#$!-&*)+>;!\)'$!/T1'4+$*(1#!4#$!01(0+1*$!
1-6(1-&$7!6)(!#>#-6/#7!#//#$!$.'*!#-6/.=&#$!6.+(!)**)2+#(!/#!0+1E(#!-&*)//12+#;!
"#$!$./+*1.'$!+*1/1$&#$7!$.'*!4#$!$./+*1.'$!)2+#+$#$!4#!0.'0#'*()*1.'!#'!$./+*&!)66.(*&!A`b#A/Ja!R!I7_O!-./;"5B!
"#!0,/.(+(#!4#!G#(!`<<<a!#$*!+'!$./14#!1.'12+#!!4#!G.(-+/#!b#A/J7!0.-6.$&!4T1.'$!G#(!<<<!b#Jc!#*!4T1.'$!0,/.(+(#!A/5!;!!
! !
H#-4$#4&'(IJK>J>K(>'
'
0!HLMN'GONH!MPP!'QR@'
'
(8$#'G'
Figure'1':'Astronaute'en'train'de'
transférer'un'container'de'plutonium'
!
1!
0.5!
1!
!
1,5!
1,5!
1!
0.5!
____!

0,%12#-.'>')'G,3S5-./'3&D1&4#/'T'.#2+E$5.1$#'52U&5-.#'
Eau
Cyclohexane
Dichlorométhane
'
0,%12#-.'?')'0,--E#/''
@*.-#!
[!
d!
A!
A/!
F/#0*(.'&%)*1E1*&!
I7I!
J7^!
I7_!
J7I!
e+-&(.!
)*.-12+#!
B!
K!
W!
BD!
!
!
B; f.+(2+.1!/#!0,/.(+(#!4#!G#(!`<<<a!#$*51/!$./+M/#!4)'$!/T#)+!]!X+$*1G1#(;!
I; \.''#(!/)!(#6(&$#'*)*1.'!4#!"#g1$!4#!/)!-./&0+/#!4#!410,/.(.-&*,)'#;!X+$*1G1#(;!
J; A#**#!-./&0+/#!4#!410,/.(.-&*,)'#!#$*5#//#!6./)1(#!.+!)6./)1(#!]!X+$*1G1#(;!
^; "#$!I!$./E)'*$!)+*(#$!2+#!/T#)+!4+!4.0+-#'*!I!6#+E#'*51/$!h*(#!0,.1$1$!6.+(!41$$.+4(#!/#!0,/.(+(#!4#!
G#(!`<<<a!]!X+$*1G1#(;!
_; F0(1(#!/T&2+)*1.'!4#!41$$./+*1.'!4+!0,/.(+(#!4#!G#(!`<<<a!!4)'$!/L#)+;!
W; \&*#(-1'#(!/#$!0.'0#'*()*1.'$!-./)1(#$!#GG#0*1E#$!4#$!1.'$!b#Jc!#*!A/5!4)'$!/)!$./+*1.'!]!
'
!"#$%&%#'?')'I'+,&-./'
F'*.+(#(!/)!.+!/#$!M.''#`$a!(&6.'$#`$a!
B; O-#'3&5&/,-'%,S53#-.#'V'W'X')'!
@!Q!F$*!6./)(1$&#!$1!X!#$*!6/+$!&/#0*(.'&%)*1G!2+#!V!
i!Q!F$*!6./)(1$&#!$1!V!#$*!6/+$!&/#0*(.'&%)*1G!2+#!X!
A!Q!F$*!'&0#$$)1(#-#'*!6./)(1$&#!
!
I; O-#'2,3E%13#'4&5.,2&D1#'Y%,-/.&.1E#'4#'>'5.,2#/Z')'!
@!Q!F$*!'&0#$$)1(#-#'*!6./)1(#!
i!Q!f#+*!h*(#!)6./)1(#!
A!Q!f#+*!h*(#!6./)1(#!
!
J; P#/'&-.#$5%.&,-/'4#'H5-'4#$'[553/'/,-.'4#/'&-.#$5%.&,-/')'!
@!Q!F'*(#!1.'$!
i!Q!F'*(#!)*.-#$!
A!Q!F'*(#!-./&0+/#$!
^; P#'/%CE25'4\1-#'3&5&/,-'C]4$,=8-#'Y$#+$E/#-.E#'+5$' Z'
+#1.'^.$#')!
@!Q! !
i!Q! !
A!Q! !
!
_; 05-/'36C#"5-#A'3&D1&4#'4#'_,$213#'`ab(@A'35'%,CE/&,-'#/.'
5//1$E#')'!
@!Q!6)(!4#$!1'*#()0*1.'$!4#!V)'!4#(!j))/$!
i!Q!6)(!4#$!/1)1$.'$!,=4(.%?'#!
A!Q!f)(!4#$!/1)1$.'$!,=4(.%?'#!#*!4#$!1'*#()0*1.'$!4#!V)'!4#(!
j))/$!
a: 05-/'3#'+CE-,3A'/,3&4#'4#'_,$213#')'`abI'W'LbA'P5'%,CE/&,-'
#/.'5//1$E#')''
@!Q!S'12+#-#'*!6)(!4#$!/1)1$.'$!,=4(.%?'#!
i!Q!f)(!4#$!/1)1$.'$!,=4(.%?'#!#*!4#$!1'*#()0*1.'$!4#!V)'!4#(!
j))/$!
A!Q!S'12+#-#'*!6)(!4#$!1'*#()0*1.'$!4#!V)'!4#(!j))/$!
!
D; P,$/D16'1-'%,$+/'+1$'2,3E%135&$#'/,3&4#'%C5-=#'46E.5.')'!
@!Q!k)!*#-6&()*+(#!)+%-#'*#!!
i!Q!k)!*#-6&()*+(#!(#$*#!0.'$*)'*#!
A!Q!k)!*#-6&()*+(#!41-1'+#!
!
K; c,1.'5++,$.'4\E-#$=&#'.C#$2&D1#'T'1-'%,$+/'+1$'2,3E%135&$#'
/,3&4#'D1&'%C5-=#'46E.5.')!
@!Q!@+%-#'*#!/L)%1*)*1.'!4#$!-./&0+/#$!
i!Q!8.-6*!4#$!/1)1$.'$!,=4(.%?'#!
A!Q!8.-6*!4#$!1'*#()0*1.'$!4#!V)'!4#(!j))/$!
!
d: P5'.#2+E$5.1$#'4\EU133&.&,-'4#'3\E.C5-#'Y`b?'W'`b?Z'#/.'4#'''''
e;d'R'`A'%#33#'41'2E.C5-,3'Y`b?'W'LbZ'#/.'4#'aI'R'`:''P#/'
&-.#$5%.&,-/'#-.$#'2,3E%13#/'4\E.C5-#'T'3\E.5.'3&D1&4#'/,-.')''
@!Q!f/+$!1-6.(*)'*#$!
i!Q!U.1'$!1-6.(*)'*#$!
AQ!<4#'*12+#$!
D1#'3#/''&-.#$5%.&,-/'#-.$#'3#/'2,3E%13#/'4#'2E.C5-,3'T'
3\E.5.'3&D1&4#:'
!
BO; O-'%$&/.53'&,-&D1#'4\,"]4#'4#'25=-E/&12'f=L'#/.'%,2+,/E'
4\&,-/')'!
@!Q!f=Ic!#*!Ll!
i!Q!f=c!#*!LIl!
A!Q!f=Ic!#*!LIl!
!
1,5!
1!
1!
1,5!
!
1!
2!
_!

`LNN!`cMLQ'0O'0!HLMN'-R@'
'
!"#$%&%#'('
B5!S'!'.=)+!4#!6/+*.'1+-!IJK!$#!4&$1'*?%(#!#'!/1M&()'*!+'!'.=)+!4T[&/1+-;!!
); </!$T)%1*!4T+'#!4&$1'*&%()*1.'!'+0/&)1(#!)/6,)!
M; AT#$*!+'#!(&)0*1.'!$6.'*)'&#!!
0; F2+)*1.'!Q! 𝑃𝑢
!"
!"# m𝑈
!"
!"# !c! 𝐻𝑒
!
!!
!
I5!"#!6/+*.'1+-!IJK!3!+'#!-)$$#!4#!IJK7O^CW!+7!/L+()'1+-!4#!IJ^7O^BO!+!#*!/L,&/1+-!4#!^7OOB_!+;!
); ")!E)(1)*1.'!4#!-)$$#!/.($!4#!/)!(&)0*1.'!#$*!Q!∆𝒎=𝒎𝒑𝒓𝒐𝒅𝒖𝒊𝒕𝒔 −𝒎𝒓é𝒂𝒄𝒕𝒊𝒇𝒔!
∆𝑚=𝑚𝐻𝑒 +𝑚𝑈 −𝑚𝑃𝑢!
@66/10)*1.'!'+-&(12+#!Q!∆𝑚=4,0015!u+!234,0410!u−238,0496!!
!!!∆𝑚=−7,1000.10!!!+!
∆𝑚=−7,1000.10!!×1,66.10!!"!Z%!
∆𝒎=−𝟏,𝟏𝟕𝟖𝟔.𝟏𝟎!𝟐𝟗𝒌𝒈'
")!E)(1)*1.'!4#!-)$$#!/.($!0#**#!(&)0*1.'!#$*!4#!−𝟏,𝟏𝟕𝟖𝟔.𝟏𝟎!𝟐𝟗𝒌𝒈'
!
M; /L&'#(%1#!/1M&(&#!#$*!𝑬=∆𝒎:%g!
@66/10)*1.'!'+-&(12+#!Q!𝐸=1,1786.10!!"×3.00×10!!!
𝑬=𝟏,𝟎𝟔𝟎𝟕𝟒:(Ke(>'B'
𝑬=𝟔,𝟔𝟑'f#S'
"T&'#(%1#!/1M&(&#!#$*!4#!W7WJ!U#V!
!
0; S'#!4&$1'*&%()*1.'!/1M?(#!𝟏,𝟎𝟔𝟎𝟕𝟒:(Ke(>'B!4.'0!6.+(!/1M&(#(!^7^!ZX!#'!+'#!$#0.'4#!1/!G)+*!Q!!
^^OOn1,06074;BO5BIR^7B_;BOB_!4&$1'*&%()*1.'$!
!
4; "L)0*1E1*&!@!4#!/)!$.+(0#!#'!6/+*.'1+-!4#!/)!$.'4#!A)$$1'1!&*)'*!/#!'.-M(#!4#!4&$1'*&%()*1.'!6)(!$#0.'4#!.'!)!Q!
Vh@A(I:(K(IXD!
'
'
!"#$%&%#'>'
'
B; "#!0,/.(+(#!4#!G#(!`<<<a!&*)'*!+'!/,3&4#'&,-&D1#7!1/!#$*!$./+M/#!4)'$!/T#)+!2+1!#$*!+'!/,3S5-.'+,35&$#;!
"T#)+!#$*!+'!$./E)'*!6./)1(#!0)(!1/!)!I!/1)1$.'$!O5[!6./)(1$&#$!`#'!#GG#*!/T&/#0*(.'&%)*1E1*&!4#!d!#*
!
_; F0(1(#!/T&2+)*1.'!4#!41$$./+*1.'!4+!0,/.(+(#!4#!G#(!`<<<a!!4)'$!/L#)+!Q!b#A/J!`$a!!!b#Jc`)2a!c!J!A/5`)2a!
!
W; ")!41$$./+*1.'!&*)'*!*.*)/#!.'!)!4T)6(?$!/T&2+)*1.'!4#!41$$./+*1.'!Q!!
'-Yi#?jZZh-Yi#`3?'Y/Z'Z'#.'-Y`3eZh?-Yi#`3?'Y/Z'Z'''
\.'0![Fe3+]!=!n(Fe3+)!/!Vsol!=!'`b#A/J!`$a!a!/Vsol=C!
[A/5]!=!n(A/5)!/!Vsol!=!3'`b#A/J!`$a!a!/Vsol=3C!!
!
@66/10)*1.'!'+-&(12+#!Q!!
[Fe3+]!=!2,5!mol/L!et!![A/5]!=!7,5!mol/L!
!
!"#$%&%#'?')''''
!
!
!
!
'
B; O-#'3&5&/,-'%,S53#-.#'V'W'X')'!
@!Q!F$*!6./)(1$&#!$1!X!#$*!6/+$!&/#0*(.'&%)*1G!2+#!V!
i!Q!F$*!6./)(1$&#!$1!V!#$*!6/+$!&/#0*(.'&%)*1G!2+#!X!
A!Q!F$*!'&0#$$)1(#-#'*!6./)(1$&#!
!
I; O-#'2,3E%13#'4&5.,2&D1#'Y%,-/.&.1E#'4#'>'5.,2#/Z')'!
@!Q!F$*!'&0#$$)1(#-#'*!6./)1(#!
i!Q!f#+*!h*(#!)6./)1(#!
A!Q!f#+*!h*(#!6./)1(#!
!
J; P#/'&-.#$5%.&,-/'4#'H5-'4#$'[553/'/,-.'4#/'&-.#$5%.&,-/')'!
@!Q!F'*(#!1.'$!
i!Q!F'*(#!)*.-#$!
A!Q!F'*(#!-./&0+/#$!
^; P#'/%CE25'4\1-#'3&5&/,-'C]4$,=8-#'Y$#+$E/#-.E#'+5$' Z'
+#1.'^.$#')!
@!Q! !
i!Q! !
A!Q! !
!
_; 05-/'36C#"5-#A'3&D1&4#'4#'_,$213#'`ab(@A'35'%,CE/&,-'#/.'
5//1$E#')'!
@!Q!6)(!4#$!1'*#()0*1.'$!4#!V)'!4#(!j))/$!
i!Q!6)(!4#$!/1)1$.'$!,=4(.%?'#!
A!Q!f)(!4#$!/1)1$.'$!,=4(.%?'#!#*!4#$!1'*#()0*1.'$!4#!V)'!4#(!
j))/$!
a: 05-/'3#'+CE-,3A'/,3&4#'4#'_,$213#')'`abI'W'LbA'P5'%,CE/&,-'
#/.'5//1$E#')''
@!Q!S'12+#-#'*!6)(!4#$!/1)1$.'$!,=4(.%?'#!
i!Q!f)(!4#$!/1)1$.'$!,=4(.%?'#!#*!4#$!1'*#()0*1.'$!4#!V)'!4#(!
j))/$!
A!Q!S'12+#-#'*!6)(!4#$!1'*#()0*1.'$!4#!V)'!4#(!j))/$!
!
D; P,$/D16'1-'%,$+/'+1$'2,3E%135&$#'/,3&4#'%C5-=#'46E.5.')'!
@!Q!k)!*#-6&()*+(#!)+%-#'*#!!
i!Q!k)!*#-6&()*+(#!(#$*#!0.'$*)'*#!
A!Q!k)!*#-6&()*+(#!41-1'+#!
!
K; c,1.'5++,$.'4\E-#$=&#'.C#$2&D1#'T'1-'%,$+/'+1$'2,3E%135&$#'
/,3&4#'D1&'%C5-=#'46E.5.')!
@!Q!@+%-#'*#!/L)%1*)*1.'!4#$!-./&0+/#$!
i!Q!8.-6*!4#$!/1)1$.'$!,=4(.%?'#!
A!Q!8.-6*!4#$!1'*#()0*1.'$!4#!V)'!4#(!j))/$!
!
d: P5'.#2+E$5.1$#'4\EU133&.&,-'4#'3\E.C5-#'Y`b?'W'`b?Z'#/.'4#'''''
e;d'R'`A'%#33#'41'2E.C5-,3'Y`b?'W'LbZ'#/.'4#'aI'R'`:''P#/'
&-.#$5%.&,-/'#-.$#'2,3E%13#/'4\E.C5-#'T'3\E.5.'3&D1&4#'/,-.')''
@!Q!f/+$!1-6.(*)'*#$!
i!Q!U.1'$!1-6.(*)'*#$!
AQ!<4#'*12+#$!
D1#'3#/''&-.#$5%.&,-/'#-.$#'3#/'2,3E%13#/'4#'2E.C5-,3'T'
3\E.5.'3&D1&4#:'
!
BO; O-'%$&/.53'&,-&D1#'4\,"]4#'4#'25=-E/&12'f=L'#/.'%,2+,/E'
4\&,-/')'!
@!Q!f=Ic!#*!Ll!
i!Q!f=c!#*!LIl!
A!Q!f=Ic!#*!LIl!
!
1
/
4
100%