Cours - PhyZik

B3
Cohésion des solides
Quel sont les phénomènes à l’échelle microscopique qui assurent la cohésion d’un solide ? Et ont-ils tous la même
influence ou intensité ?
I – Solide ionique
1) Interactions électrostatiques
Un solide ionique est constitué de cations (+) et d’anions (-) assimilés à des sphères
dures. L’ensemble est électriquement neutre.
L’interaction électrostatique entre ces ions assure la cohésion du solide ionique.
La force électrostatique assurant cette cohésion est la loi de Coulomb :
avec , constante de Coulomb
dans l’air et dans le vide
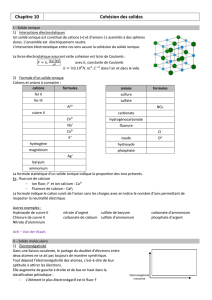
2) Formule d’un solide ionique
Cations et anions à connaitre :
cations
formules
fer II
fer III
Al3+
cuivre II
Zn2+
Na+
Ca2+
K+
hydrogène
magnésium
Ag+
baryum
ammonium
anions
formules
sulfure
sulfate
NO3-
carbonate
hydrogénocarbonate
fluorure
Cl -
oxyde
O2-
hydroxyde
phosphate
La formule statistique d’un solide ionique indique la proportion des ions présents.
Ex : fluorure de calcium
Ion fluor, F- et ion calcium : Ca2+
Fluorure de calcium : CaF2
La formule indique le cation suivit de l’anion sans les charges avec en indice le nombre d’ions permettant de
respecter la neutralité électrique.
Autres exemples :
Hydroxyde de cuivre II nitrate d’argent sulfate de baryum carbonate d’ammonium
Chlorure de cuivre II carbonate de calcium sulfate d’ammonium phosphate d’argent
Nitrate d’aluminium
Acti – Van der Waals
II – Solide moléculaire
1) Electronégativité
Dans une liaison covalente, le partage du doublet d’électrons entre
deux atomes ne se fait pas toujours de manière symétrique.
Tout dépend l’électronégativité des atomes, c'est-à-dire de leur
aptitude à attirer les électrons.
Elle augmente de gauche à droite et de bas en haut dans la
classification périodique :
L’élément le plus électronégatif est le fluor F
Electronégativité
croissante

2) Caractère polaire d’une molécule
Ex 1 : le dioxyde de carbone CO2
Les deux liaisons covalentes C=O sont polarisées mais comme cette molécule est
linéaire le dipôle résultant est nul. Celle molécule est donc apolaire.
Ex 2 : l’eau H2O
Les deux liaisons covalentes O-H sont polarisées. Comme cette molécule est coudée, la
barycentre des charges positives et négatives ne coïncide pas et la molécule est polarisée.
3) Comment interpréter la cohésion des solides moléculaires ?
Ces solides sont constitués de molécules régulièrement disposées dans l’espace.
Dans le cas des molécules polaires, il existe des interactions électrostatiques entre les dipôles permanents qui
assurent la cohésion du solide, ce sont les interactions de Van der Waals.
Ex : Chlorure d’iode solide ICl
Ces interactions existent mais sont plus faibles pour les molécules apolaires.
Des interactions attractives supplémentaires peuvent s’ajouter : ce sont les liaisons hydrogène.
Ex : l’eau H2O
Une liaison hydrogène se forme entre un atome d’H lié à un atome d’oxygène très électronégatif d’une première
molécule à un atome d’oxygène O d’une seconde molécule.
Toute molécule qui possède des groupes –O-H présente des liaisons hydrogène qui renforcent la cohésion du solide
moléculaire.
Ex : Tébu(éthanol) = 78°C et Tébu(méthoxyéthane) = -25°C
car CH3-CH2-OH possède des liaisons hydrogène et pas l’isomère CH3-O-CH3
Liaisons hydrogène dans l’éthanol
Autre ex : Les polymères absorbants (polyacrylates de sodium) sont des polymères capables d’absorber plusieurs
centaines de fois leur poids en eau. Ils sont utilisés dans les couches.
C2H5O
H
HO
C2H5
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
COO-
COO-
COO-
COO-
COO-

III – Dissolution d’un solide ionique
1) Mode de dissolution
Animation – Dissolution d’un sel
Les molécules d’eau entourent le cation en s’orientant de sorte que l’atome d’oxygène soit
au plus près du cation.
La dissolution d’un solide ionique dans un solvant polaire se déroule schématiquement en
trois étapes : la dissociation des ions du solide, solvatation des ions et la dispersion des ions dans la solution.
2) Equation d’une réaction de dissolution
Cas du chlorure de cobalt :
IV – Dissolution d’un composé moléculaire dans un solvant
1) Dissolution d’un soluté polaire dans un solvant polaire
Exp : Mélange d’acétone et de butanone. Solution obtenue homogène.
Des interactions de Van Der Waals s’établissent entre les molécules polaires de soluté et les molécules polaires de
solvant.
Les solutés polaires sont donc solubles dans les solvants polaires.
Exp : Dissolution de molécules de saccharose dans l’eau. Solution homogène qui ne conduit pas le courant
électrique.
La grande solubilité du saccharose dans l’eau résulte :
- Des interactions de Van Der Waals qui interviennent entre les molécules de soluté (le saccharose) et les molécules
de solvants (eau) ;
- Et la formation de nombreuses liaisons hydrogène.
La solubilité est favorisée lorsque des liaisons hydrogène s’établissent entre les molécules de soluté.
2) Dissolution d’un soluté apolaire dans un solvant apolaire
Exp : Diiode dans l’eau. Coloration jaune. Il reste du diiode solide au fond du tube à essais.
On ajoute de l’heptane à cette solution dans une ampoule à décanter.
L’heptane initialement incolore prend une teinte fuchsia et la solution aqueuse s’éclaircie. Le diiode a disparu.
Les solutés moléculaires apolaires ou peu polaires sont généralement solubles dans les solvants apolaires.
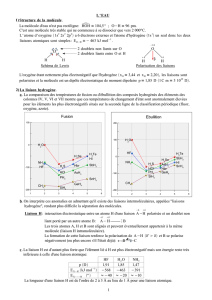
V – Concentration d’un ion en solution
1) Concentration molaire en soluté apporté
Ex : On prépare une solution de de chlorure de cobalt dans d’eau
et concentration molaire
où est la masse molaire du soluté
2) Concentration molaire d’une espèce dissoute
Ex :
Etat
avancement
Quantités de matière (mol)
initial
0
0 0
en cours
final
0
Donc finalement :
et
DI - Préparation d'une solution ionique
1
/
3
100%