cliquant ici

SOMMAIRE
Organisateurs :
A. RAULT (Suresnes)
1. Apport diagnostique et thérapeutique de la radiologie
S. SIRONNEAU (Bordeaux)
2. Apport diagnostique et thérapeutique de l’endoscopie
C. NIZOU (Suresnes)
3. Hémorragie d’origine grèlique
Q. DENOST (Bordeaux)
4. Hémorragie d’origine colique
F. BRETAGNOL (Suresnes)
5. Que faire lorsque l’origine du saignement n’est pas retrouvée ?
N. CHAFAI (Paris)

APPORT DIAGNOSTIQUE ET THERAPEUTIQUE DE LA RADIOLOGIE
Sandrine SIRONNEAU
Hôpital Bagatelle Bordeaux
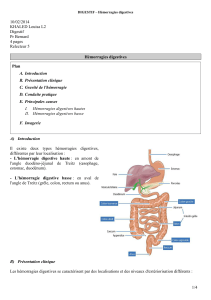
. L’hémorragie digestive (HD) est un motif fréquent de consultation ou de passage aux
urgences : 20 à 27 cas pour 100000 en ce qui concerne l’hémorragie digestive basse, (1) Elle
survient plus fréquemment chez les patients âgés avec un taux de mortalité (3,6%) et de
morbidité significatifs.
. Les hémorragies entéro-coliques sont un symptôme, elles ont pour origine un saignement
digestif situé après l’angle de Treitz. Les pathologies responsables sont variées, compte tenu
de la longueur du tube digestif, mais la cause la plus fréquente (60%) est la diverticulose
colique (2).
. Le but de cet exposé est de préciser la place de l’imagerie dans une prise en charge qui doit
être multidisciplinaire, l’enjeu étant la mise en évidence rapide et précise du site de
saignement, afin de guider la prise en charge thérapeutique.
Stratégie thérapeutique :
Après restauration, si nécessaire de l’état hémodynamique, une enquête étiologique
est réalisée, un bilan endoscopique haut et éventuellement une rectosigmoidiscopie,
afin d’éliminer une cause basse évidente (3).
La distinction entre les hémorragies digestives hautes et basses n’est pas toujours
facile, un saignement de bas débit du colon droit pouvant simuler une HD haute et 10
à 15 % des HD basses ont des causes hautes (4,5).
Une hémorragie digestive basse cesse spontanément ou répond à un traitement
médical dans 70 à80 % des cas.
Le bilan en imagerie ne se conçoit qu’en cas de négativité diagnostique et /ou
thérapeutique de cette prise en charge médicale les outils dont nous disposons sont
l’angioscanner et l’artériographie.

L’angioscanner abdominal :
Il est facilement disponible, réalisable en urgence (en l’absence des contre-indications
que sont l’insuffisance rénale et l’antécédent de choc à l’iode avéré), sur un patient
stable et période aigue de saignement, car les HD peuvent être intermittentes d’une
minute à l’autre (6).
Il faut impérativement réaliser trois hélices : sans injection, au temps artériel puis une
troisième hélice portale (90 s).
Le balisage du tube digestif est à proscrire : ni eau, ni contraste dit positif (blanc) qui
dilueraient ou masqueraient une extravasation de produit de contraste) (7,8)
Le signe le plus spécifique est l’extravasation de produit de contraste dans la lumière
digestive d’où l’importance du passage sans injection qui permet de vérifier que cette
fuite ne correspond pas à une image spontanément dense (corps étranger, stercolithe
diverticulaire, résidu de comprimé, suture chirurgicale).
Cette extravasation permet de situer le saignement, et même, grâce à des
reformatages l’artère responsable.
Par ailleurs si le scanner ne montre pas d’extravasation il peut objectiver une
pathologie : épaississement pariétal, des signes d’ischémie, de colite, une tumeur ou
malformation vasculaire (9).
Attention cependant des diverticules sans signes de complications ne peuvent être
considérés comme responsables.
D’après une étude sur modèle animal, l’absence d’extravasation permet d’exclure un
saignement de plus de 0,3 ml.min (10)
Des études ont montré les performances des scanners multi détecteurs par rapport
aux constations endoscopiques et chirurgicales, avec une sensibilité de 79 à 91%(5,
11,12). cependant plus le saignement est abondant meilleure est la sensibilité de
détection (7).
Lorsque le scanner ne montre pas d’extravasation, il ne faut donc pas hésiter à le
refaire en cas de persistance ou de nouvel épisode hémorragique.
Scintigraphie aux globules rouges marqués (Tech 99m)
Elle permet de détecter des saignements de 0,1 à 0,5 ml / min (13), et est plus utilisée dans
les pays anglo-saxons, moins en France ou elle est peu disponible en urgence.
Ses limites sont les faux positifs 22% et sa faible résolution spatiale.

L’artériographie :
Il s’agit d’un examen invasif dont la réalisation ne se conçoit, depuis l’avènement des scanners
multi détecteurs, uniquement dans un but thérapeutique.
Elle n’a pas de valeur de détection supplémentaire par rapport au scanner : une étude sur
modèle porcin a prouvé que le scanner peut objectiver un saignement des 0,3 ml / sec contre
0,5 ml/sec pour l’artériographie (10).
Elle vient donc comme un examen de seconde intention après échec des traitements
endoscopiques et en alternative à la chirurgie (patients fragiles).
Elle est guidée par le scanner injecté qui aura mis en évidence l’extravasation (qui n’est
presque jamais visualisée dans les hémorragies d’origine veineuse (8)), et permet grâce aux
reconstructions vasculaires de réaliser d’emblée un cathétérisme et une embolisation sélective
de l’artère responsable.
Les techniques endovasculaires se sont nettement améliorées grâce aux progrès du matériel
(microcathéters) qui rendent possible un cathétérisme plus sélectif des artères responsables
ce qui permet d’une part des injections supra sélectives plus performantes pour visualiser le
saignement et d’autre part de réaliser une embolisation la plus sélective possible afin d’éviter
la reprise en charge par des collatérales.
Il existe différents matériel d’embolisation (micro particules, colle biologique, fragments de
gélatine) : le choix le niveau de cathétérisme et des matériaux d’embolisation se discute au
cas par cas ainsi qu’en fonction de l’expérience de l’opérateur, avec plutôt, pour les HD
basses, l’utilisation de microcoils ou de microparticules (de plus de 300 microns) (3, 14,15).
Au terme de la procédure, le désilet artériel peut être laissé en place, pour la surveillance en
réanimation et la réalisation d’une nouvelle embolisation en cas de récidive hémorragique.
Les causes d’échec techniques sont :
La non visualisation du saignement, compte tenu de son caractère intermittent : il faut
donc réaliser l’artériographie en période hémorragique et certaines équipes utilisent
donc des vasodilatateurs, des thrombolytiques ou des anticoagulants pour sensibiliser
l’examen (16,17).
L’artère responsable peut ne pas être cathétérisée en raison de spasmes, de
sinuosités, d’athérosclérose des patients âgés ou de la survenue d’une dissection.

Efficacité du traitement endovasculaire :
Une revue de la littérature (18), rapporte des taux d’efficacité (mais HD hautes et
basses confondues) : technique de 80 à 100%, clinique 71 à 100 % (91 % pour les
saignements entéro-coliques) avec un risque de récidive de 21 % en sachant que ce
risque est nettement plus important pour les HD hautes.
Ces résultats dépendent de la pathologie : l’embolisation des hémorragies d’origine
diverticulaire est plus efficace que celles de l’angiodysplasie (19).
En cas d’échec, en fonction de l’état clinique du patient mais aussi de la cause de ce
saignement, une nouvelle embolisation peut être proposée et certaines équipes utilisent
l’injection intra artérielle de vasopressine, cependant cette procédure compte de nombreuses
contre-indications et est lourde à mettre en œuvre (15).
Il est aussi possible de réaliser pendant l’artériographie, un marquage du segment impliqué
dans le saignement par des micro-coils radio opaques repérables au bloc en cas d’échec des
différentes procédures.
Les complications concernent moins de 2% des patients : l’ischémie est le plus souvent
transitoire, résolutive. De rares migrations du matériel d’embolisation peuvent survenir avec
des conséquences potentiellement graves (14,15).
Il n’existe pas de consensus quant à la place du traitement endovasculaire par rapport à la
chirurgie (20, 21). Les premières études comparant embolisation et chirurgie objectivent la
même efficacité, cependant ces études sont peu nombreuses et il existe un biais de
recrutement (population âgées, patients fragiles, ne pouvant bénéficier de la chirurgie) et par
ailleurs elles sont basées sur des embolisations proximales.
Une chirurgie réglée lorsque le site de saignement est offre des résultats probants avec 14 %
de récidive. Lorsque la chirurgie est réalisée sans cible authentifiée les résultats sont moins
bons (42%) (22), ainsi quel que soit le traitement : chirurgical ou radiologique il doit être guidé
par l’angioscanner.
Conclusion :
La prise en charge est multidisciplinaire.
Localiser le saignement de façon précise et rapide est le principal enjeu.
Le diagnostic positif topographique et étiologique va orienter la stratégie
thérapeutique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%