Traitements chirurgicaux des maladies fonctionnelles œsogastriques

M. Winiker
A. Schoepfer
N. Demartines
P. Allemann
introduction
Les maladies fonctionnelles du tractus digestif haut compren-
nent un spectre large de maladies, pouvant paraître apparentées
dans leur présentation ou dans leur physiopathologie. Elles
nécessitent cependant une prise en charge très différente.
Ces maladies, dites fonctionnelles, sont souvent handicapan tes
pour le patient avec une nette diminution de la qualité de vie.
Si la base thérapeutique est le plus souvent médicale, l’ap-
proche chirurgicale est néanmoins nécessaire dans un certain
nombre de situations. Il conviendra de garder à l’esprit que le
traitement vise une amélioration des symptômes (chirurgie fonctionnelle). Il est
donc primordial de préserver au maximum l’intégrité des structures anatomiques
et de balancer le risque chirurgical, certes faible, avec le bénéfice attendu. Dans
cette optique, il est clair qu’une prise en charge multidisciplinaire chirurgico-gas-
troentérologique est fondamentale. Une revue de la prise en charge, des indica-
tions opératoires et des résultats principaux concernant les maladies fonction-
nelles œso-gastriques est présentée dans cet article.
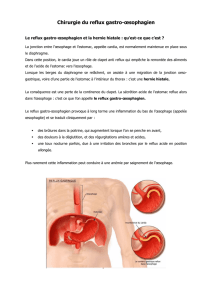
maladie de reflux gastro-œsophagien
Définition
Le reflux anormal du contenu gastrique dans l’œsophage est provoqué par
une insuffisance du sphincter œsophagien inférieur (SOI). Il s’agit d’une pathologie
extrêmement fréquente, avec 7% de la population évoquant des symptômes quo-
tidiens et 33% ayant des symptômes une fois par mois.1 Les principaux facteurs
de risque sont l’obésité, la présence d’une hernie hiatale et certaines conditions ou
maladies modifiant la motilité œsophago-gastrique (transplantés pulmonaires,
parkinsoniens, maladies neurodégénératives, fibrose kystique).
Diagnostic
Les symptômes peuvent être typiques, atypiques ou même extra-digestifs,
comme mentionné dans le tableau 1. Un certain nombre de patients avec des
Surgical treatment of gastroesophageal
diseases
Gastroesophageal functional diseases com-
prise several pathologies impending upper
gastrointestinal function : reflux disease, hiatal
hernias, short esophagus and achalasia. Their
presentation may be similar, but their treat-
ment differs on many points. The initial ap-
proach consists of lifestyle changes and me-
dical management. However, surgical treat-
ment is sometimes necessary. Strict patient
selection ensures good long term results, while
limiting the risk of complications. This selec-
tion is based on precise functional assess-
ment and management in the context of multi-
disciplinary discussions. This article aims to
discuss current aspects on general manage-
ment, functional investigations and surgical
treatments available.
Rev Med Suisse 2015 ; 11 : 1351-6
Les pathologies fonctionnelles œsogastriques regroupent plu-
sieurs maladies touchant la fonction digestive haute : la mala-
die de reflux, les hernies hiatales, l’œsophage court et l’acha-
lasie. Leur mode de présentation est parfois similaire, mais leur
traitement diffère sur de nombreux points. L’approche initiale
passe souvent par une modification de l’hygiène de vie et une
prise en charge médicale. Mais une prise en charge chirurgi-
cale est parfois nécessaire. Une sélection très stricte des pa-
tients permet de garantir un bon résultat à long terme, tout en
limitant le risque de complications. Elle repose sur un bilan
fonctionnel précis et une prise en charge dans le cadre de dis-
cussions multidisciplinaires. Cette revue fait un point actuel
sur la prise en charge générale, les bilans nécessaires et les
traitements chirurgicaux disponibles.
Traitements chirurgicaux
des maladies fonctionnelles
œsogastriques
mise au point
Drs Michael Winiker et
Pierre Allemann
Pr Nicolas Demartines
Service de chirurgie viscérale
Dr Alain Schoepfer
Service de gastro-entérologie
et d’hépatologie
CHUV, 1011 Lausanne
Revue Médicale Suisse
–
www.revmed.ch
–
17 juin 2015 1351
31_36_38650.indd 1 11.06.15 09:18

lésions pathologiques visibles à l’endoscopie peuvent
également être complètement asymptomatiques.1 Le diag-
nostic est principalement basé sur l’anamnèse approfon-
die, qui peut être affinée par un essai positif de prescription
d’un inhibiteur de la pompe à protons (IPP). Les symp-
tômes de reflux pouvant aussi être révélateurs d’une pa-
thologie gastrique plus grave (gastrite, cancer), il conviendra
de compléter le bilan, au minimum, par une œsophago-
gastro-duodénoscopie (OGD), cette dernière mettant en
évidence dans 50% des cas des pathologies de la muqueu-
se du bas œsophage (œsophagite, endobrachyœsophage
de Barrett)2 (figure 1) ou la présence d’une hernie hiatale.3
Le diagnostic formel d’une maladie de reflux repose sur la
pH-métrie, effectuée en ambulatoire soit par sonde naso-
œsophagienne, soit par capsule œsophagienne. Cet exa-
men enregistre le pH de 24 h et les éventuels symptômes
ressentis par le patient. Un score de corrélation pH-symp-
tômes peut alors être calculé (score de Demeester), pré-
dictif d’une bonne réponse au traitement chirurgical.4 Fina-
le ment, le bilan d’un patient potentiellement éligible à la
chirurgie comprendra également une manométrie œsopha-
gienne, afin d’exclure un trouble de la motilité œsopha-
gienne, qui contre-indiquerait une fundoplicature.
Traitement
Le traitement primaire de la maladie de reflux débute
par des mesures conservatrices modifiant l’hygiène de vie
(perte de poids, éviter les repas riches en graisse, dossier
du lit positionné à 30°, prise des repas à distance du cou-
cher). Si ces mesures simples ne suffisent pas, on débutera
un traitement par IPP ou antagonistes de récepteur hista-
minique.1 La chirurgie sera pro posée dans les indications
suivantes : le refus de médication à long terme, une intolé-
rance au traitement médicamenteux, une persistance des
symptômes malgré un traitement maxi mal, une manifesta-
tion extradigestive avec échec sous traitement antiacide.1
A noter que la littérature a clairement démontré un avan-
tage en termes de coût/efficacité pour l’approche chirurgi-
cale à long terme. Ce fait explique le recours à la chirurgie
plus libérale dans les pays à forte planification sanitaire
étatisée (Scandinavie, Angleterre).
La fundoplicature selon Nissen consiste à entourer la
jonction gastro-œsophagienne par une valve gastrique à
360°. Il s’agit du gold standard chirurgical dans la majorité
des centres.5 La fundoplicature selon Toupet est une alter-
native de valve postérieure à 270°. Si cette dernière tech-
nique présente moins de dysphagies postopératoires im-
médiates, les résultats à long terme sont équivalents entre
les deux techniques, autant du point de vue de la dyspha-
gie que du contrôle du reflux. La fundoplicature peut, le cas
échéant, être effectuée conjointement à d’autres procédu res,
dans le cadre d’une réparation de hernie hiatale ou du trai-
tement de l’œsophage court (voir chapitres s’y référant). La
mortalité de la fundoplicature laparoscopique est très basse,
de l’ordre de 0,1%.6 Les suites postopératoires immédiates
sont souvent accompagnées d’une dysphagie précoce (30-
40% des patients), liée à l’inflammation locale et régressant
en 4-6 semaines de manière spontanée. Les résultats à
moyen et long termes sont bons, avec une satisfaction de
90% des patients à cinq ans et une amélioration de la qua-
lité de vie jusqu’à dix ans après l’intervention (sans tout de
même atteindre le niveau de qualité de vie de la population
générale). En termes de contrôle du reflux, on notera tout
de même qu’environ 50% des patients devront reprendre
une médication d’IPP à cinq ans, mais ceci avec un bon con-
trôle des symptômes (ce qui n’était pas forcément le cas
avant la chirurgie). Les complications tardives les plus fré-
quentes sont le
gas bloat
(l’impossibilité d’éructer) et les
flatulences, rencontrés chez environ 10-15% des patients. La
dysphagie tardive et la récidive de reflux sont deux condi-
tions pour lesquelles une réintervention peut être indiquée.
On estime qu’entre 5 et 10% des patients devront être ré-
opérés à dix ans.
hernie hiatale
Définition
Un glissement du contenu abdominal dans l’orifice hiatal
définit une hernie hiatale. La prévalence exacte est incon-
nue, mais importante, estimée entre 10 et 50% de la popu-
lation nord-américaine, selon les séries.3 Normalement, la
fusion entre le fascia endothoracique et le fascia dia phrag-
mati que inférieur forme la membrane phréno-œsophagien ne
(mem brane de Laimer), qui ferme cet orifice naturel sur
tout le pourtour de la jonction gastro-œsophagienne.3 Cette
région anatomique est cependant exposée à la pression de
la cavité abdominale et donc à risque de faiblesse. L’obé-
sité et l’âge sont deux facteurs de risque importants de
hernie hiatale.7 Les hernies hiatales sont séparées en deux
1352 Revue Médicale Suisse
–
www.revmed.ch
–
17 juin 2015
Tableau 1. Symptomes GERD (Gastroesophageal
reflux disease)1
Symptômes typiques
Régurgitations acides, brûlures d’estomac
Symptômes atypiques
Pression épigastrique, lourdeurs d’estomac, épigastralgies, dyspepsie,
nausées, ballonnements et éructations
Symptômes extra-digestifs
Toux chronique, bronchospasme, enrouement, maux de gorge, asthme,
laryngite, érosions dentaires
Figure 1. Hernie hiatale avec œsophage de Barrett
31_36_38650.indd 2 11.06.15 09:18

Revue Médicale Suisse
–
www.revmed.ch
–
17 juin 2015 1353
types et quatre sous-types (figure 2) : les hernies axiales ou
par glissement (type I, 85% des cas) et les hernies paraœ-
sophagiennes, subdivisées en hernies par roulement (type
II, 10% des patients), hernies mixtes (type III) – combinai-
son des deux types I et II – et les types IV, si un autre or-
gane se retrouve dans la hernie (plus fréquent : côlon, rate,
grêle).8
Diagnostic
La plupart des patients sont asymptomatiques. Seuls
5-10% présentent des symptômes variés, sous la forme
d’épigastralgies, de reflux, de régurgitation ou d’une dys-
phagie basse. Les patients présentant une hernie de type II,
III ou IV peuvent développer une obstruction mécanique ou
un volvulus gastrique.3 La clinique typique du volvulus (épi-
gastralgie sévère, efforts de vomissement non productifs
et impossibilité de mettre une sonde naso-gastrique) est
connue sous le nom de triade de Borchardt. Des lésions
d’ischémie chronique, connues sous le nom d’ulcères de
Cameron, peuvent également se développer et être à l’ori-
gine d’une anémie ferriprive ou d’un méléna. Le bilan initial
comprendra une OGD.3 Chez les patients candidats à une
chirurgie (cf. ci-dessous), il sera complété par une imagerie
permettant de typiser la hernie (transit à la gastrographine
ou CT thoraco-abdominal) et par une manométrie haute
définition (HD), afin d’exclure de gros troubles de la moti-
lité œsophagienne. En cas de reflux gastro-œsophagien, il
conviendra également d’effectuer une pH-métrie.
Traitement
La prise en charge dépend du type de hernie et du mode
de présentation.
Il n’y a pas d’indication opératoire pour les hernies de
type I asymptomatiques. Ce type de hernie est cependant
fréquemment associé à une maladie de reflux et son trai-
tement sera directement lié à la prise en charge de la ma-
ladie de reflux (mêmes indications opératoires, cf. para-
graphe s’y rapportant). La hernie hiatale sera simplement
corrigée au cours de la fundoplicature. Les hernies para-
œsophagiennes (type II, III ou IV), même asymptomati ques,
peuvent être associées à la survenue de complications
potentiellement graves, mais heureusement rares (moins de
2% par an). Le risque opératoire n’étant cependant pas nul
(situé entre 1 et 5%, tous patients confondus), une répara-
tion chirurgicale élective devra être discutée au cas par cas,
en fonction de l’âge et des comorbidités présentées par le
patient. Il est clair qu’en cas de présentation aiguë (volvulus,
ulcère hémorragique ou nécrose gastrique), l’indication
sera formelle, malgré un risque très important de compli-
cations et de mortalité, respectivement 30-50% et 5-10%.
Le gold standard du traitement chirurgical est une ap-
proche laparoscopique, avec résection du sac herniaire, fer-
meture du hiatus par des points de rapprochement des piliers
du diaphragme. La clé de l’intervention consiste à rétablir
une jonction gastro-œsophagienne intra-abdominale sans
tension (voir chapitre sur l’œsophage court). L’adjonction
d’une fundoplicature se fait chez les patients présentant du
reflux en préopératoire. Le rôle de la gastropexie (fixation
de l’estomac au diaphragme ou à la paroi abdominale) est
débattu, peu étudié dans la littérature et ne diminue clai-
rement pas le risque de récidive. Pour notre part, nous ré-
servons cette technique à des patients polymorbides, opé-
rés dans des situations urgentes. L’ajout d’un filet pour ren-
forcer le diaphragme, de quelque nature que ce soit, n’a
jamais été associé à une quelconque diminution de risque
de récidive dans la littérature, mais expose au contraire le
patient à des risques de complications supplémentaires
graves, tels que dysphagie, migration intragastrique et lé-
sions œsophagiennes. En l’absence de bénéfice clairement
prouvé, cette technique ne devrait pas, à nos yeux, consti-
tuer une approche standard.
Quelle que soit la technique, le taux de récidives est
malheureusement très élevé (décrit jusqu’à 40% à cinq ans),
mais la majorité ne sont pas symptomatiques.8
œsophage court
L’œsophage court est une entité associée à la présence
d’une hernie hiatale de grande taille
et de longue date
. Son
existence est un sujet controversé, y compris au sein même
de la communauté chirurgicale. Sa présence a été rappor-
tée dans 0-60% des cas présentant une hernie hiatale. Son
développement serait acquis à la suite d’une maladie de
reflux de longue durée. L’inflammation chronique péri-
œsophagienne en découlant induirait la formation d’une
fibrose et d’une contraction de la
muscularis propria
externe,
conduisant à un raccourcissement progressif de l’œsopha-
ge.8 Selon certains auteurs, la non-reconnaissance de cette
pathologie lors d’une cure de hernie hiatale pourrait expli-
quer une grande majorité de récidives, par traction continue
sur le montage antireflux.8
Ce diagnostic peut être suspecté à l’OGD, au transit à la
gastrographine ou sur un CT-scan thoraco-abdominal. Il ne
sera toutefois confirmé de manière formelle qu’en intra-
opératoire. Après dissection de l’œsophage distal, on parle
d’œsophage court si la jonction gastro-œsophagienne ne
reste pas en infradiaphragmatique, sans traction.9
Le traitement, outre celui de la hernie hiatale associée,
consiste en une plastie d’allongement de l’œsophage, par
une section gastrique au niveau du fundus (gastroplastie
selon Collis). Cette intervention est effectuée par laparo-
Figure 2. Hernie hiatale en inversion
31_36_38650.indd 3 11.06.15 09:18

scopie, à l’aide d’agrafeuses linéaires angulées.10 Les prin-
cipaux risques de cette plastie gastrique sont l’apparition
précoce d’une fistule gastrique sur la ligne d’agrafes (2-3%) ou
le développement tardif d’une sténose (5%). Cette techni que
très intéressante permet, selon la littérature, de réduire le
taux de récidives de hernie hiatale de 40% à 10% des cas.
achalasie
Définition
Il s’agit d’une maladie rare, avec une incidence de 1 :
100 000 habitants, touchant de manière égale les femmes
et les hommes.11 L’achalasie est un trouble de la motilité
œsophagienne primaire, qui combine une absence de pé-
ristaltisme tubulaire et une perturbation de la relaxation
du sphincter œsophagien inférieur (SOI).12 La physiopatho-
logie exacte est mal connue. Une des hypothèses serait un
processus auto-immun sur une base génétique, associé à
une lésion virale (herpétique ?) déclenchante.13,14 L’inflam-
mation résultante amènerait une perte des neurones inhi-
biteurs du plexus myentérique.11
Diagnostic
La dysphagie est le symptôme le plus fréquemment rap-
porté, parfois accompagné de régurgitations, de douleurs
thoraciques ou d’une perte pondérale parfois importante.13,14
L’achalasie est une pathologie méconnue et les symptômes
sont parfois mis sur le compte d’une maladie de reflux.14
L’OGD constitue à notre sens le premier outil diagnos-
tique. Elle permettra d’éliminer une cause d’achalasie se-
condaire (obstruction mécanique intrinsèque, œsophagite
à éosinophiles ou cancer de la jonction œso-gastrique). Ce
dernier diagnostic doit à tout prix être éliminé par des
biopsies, surtout en cas de symptomatologie rapidement
progressive. Un transit à la gastrographine peut également
être effectué, montrant une image dynamique de la déglu-
tition, généralement typique de l’achalasie. Une sténose en
bec de flûte peut parfois apparaître, posant le diagnostic
différentiel avec une sténose cancéreuse (figure 3).13 La
manométrie HD est le gold standard du diagnostic de l’acha-
lasie,13 avec une spécificité de plus de 90%. Une relaxation
incomplète du SOI pendant la déglutition, avec une pression
résiduelle L 10 mmHg, caractérise une achalasie.13 La ma-
nométrie HD permet de classifier la maladie en trois caté-
gories distinctes et cliniquement relevantes (classification
de Pandolfino) (tableau 2, figure 4).15,16 Le type I est carac-
térisé par une absence d’une pression dans l’œsophage
distal de plus de 30 mmHg (achalasie classique). Le type II
est caractérisé par une pression élevée (L 30 mmHg) dans
le bas œsophage lors de la déglutition (pressurisation pan-
œsophagienne) et le type III présente des contractions
spastiques de l’œsophage distal.13
Traitement
Il existe une multitude d’approches, dont les succès sont
variés, de même que les effets secondaires. Le traitement
médicamenteux (nitrates, bloqueurs des canaux calciques)
1354 Revue Médicale Suisse
–
www.revmed.ch
–
17 juin 2015
Figure 3. Bec de flûte
Tableau 2. Classification de Pandolfino de
l’achalasie13
Type I
Achalasie classique
• Pas de contraction spécifique de l’œsophage
• Spasme du sphincter œsophagien inférieur
Type II
Achalasie avec compression
• Pression augmentée sur toute la longueur de l’œsophage
(pressurisation panœsophagienne)
• Absence de péristaltisme intact, pour L 20% des déglutitions
Type III
Achalasie spastique
• Spasmes localisés de l’œsophage
• Absence de péristaltisme intact, vitesse de propagation élevée pour
L 20% des déglutitions
Figure 4. Manométrie haute résolution
Image typique d’une achalasie dans une manométrie à haute résolution.
On observe une hypertonie du muscle sphincter inférieur et une absence
de motilité propulsive. Les «D» caractérisent les déglutitions.
D D D D
Hypertonie du
sphincter inférieur
Absence de péristaltisme de
l’œsophage tubulaire
31_36_38650.indd 4 11.06.15 09:18

Revue Médicale Suisse
–
www.revmed.ch
–
17 juin 2015 1355
a un succès modeste (13-49% d’améliorations des symptômes)
et est associé à des effets secondaires importants (hypo-
tension, céphalées et étourdissement). Il ne présente donc
que peu d’intérêt en pratique.14 La toxine botulinique A
(Botox) est un inhibiteur présynaptique de l’acétylcholine
et cause une paralysie du SOI. Ce traitement est appliqué
par injection directe dans le sphincter sous contrôle en-
doscopique. 80% des patients montrent une bonne réponse
immédiate avec peu d’effets secondaires, malheureusement
moins de 60% des patients sont en rémission après une an-
née.13 La dilatation pneumatique (DP) est la méthode non
chirurgicale la plus efficace. Un ballon est introduit dans
l’œsophage distal par voie endoscopique et les fibres mus-
culaires circulaires sont déchirées par gonflage du ballon à
une pression donnée.17 La myotomie selon Heller est le
gold standard chirurgical. Elle consiste en une section lon-
gitudinale des deux couches musculaires circulaires et lon-
gitudinales, s’étendant sur une distance de 5-6 cm sur
l’œsophage et de 3 cm sur le cardia. Cette intervention est
généralement effectuée en laparoscopie et sera accompa-
gnée d’une fundoplicature antérieure selon Dor, qui per-
mettra de réduire l’incidence du reflux postmyotomie de
40% à moins de 5%.18 Les comparatifs les plus récents de
ces deux approches (dilatation versus myotomie) montrent
un avantage pour la chirurgie en termes de rémission des
symptomes à cinq ans (79% vs 61%) et dix ans (76% vs 47%),
au prix d’un risque de perforation œsophagienne ou gas-
trique plus important dans le groupe chirurgical (4,8% vs
2,4%).19 Il est à noter cependant que les perforations chi-
rurgicales sont généralement réparées immédiatement en
peropératoire, sans grande conséquence clini que. Ceci se
traduit donc par un risque de perforation nécessitant une
réintervention en faveur de la chirurgie (0,6% vs 2,4%). Dans
notre pratique, nous privilégierons donc une approche
chirurgicale primaire pour tout patient en bonne forme,
sans comorbidité majeure et ayant une bonne espérance
de vie. Dans le cas contraire, une approche endoscopique
sera proposée.
Pour terminer, la myotomie perorale endoscopique
(POEM) est une technique nouvelle, à mi-chemin entre la
chirurgie et l’endoscopie. Si les résultats préliminaires
sem blent intéressants (82% de succès cliniques à un an), il
n’existe pour l’heure aucune donnée à long terme sur le
succès et la sécurité de cette technique, qui reste donc ex-
périmentale.13 On notera en particulier l’apparition d’un
reflux post-myotomie chez 46% des patients.20
Quelle que soit l’approche, il est très important d’insister
sur la nécessité d’un suivi endoscopique à long terme, en
raison d’un risque augmenté de cancer œsophagien chez
ces patients.18
conclusions
L’approche chirurgicale des pathologies fonctionnelles
œsogastriques est bien établie depuis des années, et s’est
peu à peu standardisée, même si quelques aspects sont
encore débattus. Dans certaines situations, avec une bonne
sélection des patients, cette approche a démontré un rap-
port coût/efficacité favorable à long terme, comparée à un
traitement médicamenteux. Dans toutes les situations, il
conviendra de garder à l’esprit qu’il s’agit de chirurgie fonc-
tionnelle, dont le but est de venir en aide à un patient dont
la qualité de vie est altérée en raison de symptômes divers.
L’objectif consistera donc à offrir au patient la méthode pré-
sentant les meilleurs résultats à long terme, tout en minimi-
sant la survenue de complications pouvant s’avérer poten-
tiellement invalidantes et catastrophiques. La sélection des
patients par un bilan préopératoire rigoureux et une techni-
que opératoire irréprochable et rationnelle constituent à
nos yeux deux points critiques, permettant de limiter le
risque de péjorer une qualité de vie déjà diminuée. Pour
terminer cet article, il nous paraît important de rappeler
que les pathologies œsogastriques fonctionnelles sont une
entité à cheval entre la gastroentérologie et la chirurgie.
Une approche multi disciplinaire avec discussion et prise en
charge conjointe constitue donc à nos yeux la clé de voûte
du succès d’une bonne indication.
Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec
cet article.
Implications pratiques
L’approche multidisciplinaire (gastroentérologie, médecine,
chirurgie) est fondamentale
Le bilan de base comprend au minimum une gastroscopie.
Il sera complété d’une imagerie et d’investigations fonction-
nelles (manométrie, pH-impédance-métrie) selon les cas
La chirurgie du reflux et de la hernie hiatale offre d’excel-
lents résultats fonctionnels à long terme, permettant bien
souvent un arrêt du traitement médical, sous réserve d’une
bonne sélection des patients
La prise en charge initiale de l’achalasie (endoscopique ou
chirurgicale) doit se discuter au cas par cas, en fonction des
comorbidités du patient
>
>
>
>
1 ** Badillo R, Francis D. Diagnosis and treatment of
gastroesophageal reflux disease. World J Gastrointest
Pharmacol Ther 2014;5:105-12.
2 Vakil N. The initial diagnosis of GERD. Best prac-
tice & research. Clin Gastroenterol 2013;27:365-71.
3 ** Roman S, Kahrilas PJ. The diagnosis and mana-
gement of hiatus hernia. BMJ 2014;349:g6154.
4 * Oelschlager BK, et al. Long-term outcomes after
laparoscopic antireflux surgery. Am J Gastroenterol
2008;103:280-7 ; quiz 288.
5 * Bredenoord AJ, Pandolfino JE, Smout AJ. Gastro-
oesophageal reflux disease. Lancet 2013;381:1933-42.
6 Niebisch S, Peters JH. Update on fundoplication
for the treatment of GERD. Curr Gastroenterol Rep
2012;14:189-96.
7 Pandolfino JE, et al. Obesity : A challenge to eso-
phagogastric junction integrity. Gastroenterology 2006;
130:639-49.
8 Mori T, Nagao G, Sugiyama M. Paraesophageal
hernia repair. Ann Thorac Cardiovasc Surg 2012;18:
297-305.
9 * Kohn GP, et al. Guidelines for the management
of hiatal hernia. Surg Endosc 2013;27:4409-28.
10 * Horvath KD, Swanstrom LL, Jobe BA. The short
Bibliographie
31_36_38650.indd 5 11.06.15 09:18
 6
6
1
/
6
100%