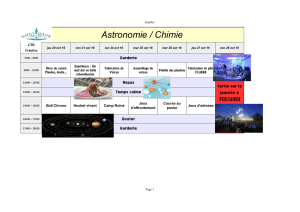
Tomographie par cohérence optique

1
Tomographie par Cohérence Optique
Arnaud Dubois
Laboratoire Charles Fabry, CNRS UMR 8501, Institut d’Optique Graduate School, Université Paris-Sud,
2 avenue Augustin Fresnel, 91127 Palaiseau Cedex, France
arnaud.dubois@institutoptique.fr
25 janvier 2011
1. Introduction
Dans le domaine biomédical, tant pour les activités cliniques qu’en recherche, des techniques d’imagerie
de plus en plus performantes sont requises, capables de fournir des images en 3 dimensions avec une
résolution atteignant l’échelle cellulaire. Plusieurs techniques, permettant d’obtenir des images
morphologiques ou fonctionnelles, sont couramment utilisées : l’imagerie par résonance magnétique (IRM),
la tomographie par rayons X, l’échographie et la microscopie optique. L’IRM peut atteindre une résolution
d’environ 10 µm en appliquant des champs magnétiques très intenses. Cette technique s’avère néanmoins
très onéreuse et pose de sérieuses difficultés pratiques. La tomographie X peut également révéler des
microstructures avec une résolution d’environ 10 µm mais nécessite alors un système de micro-focalisation
très élaboré et de complexes algorithmes de reconstruction d’images. L’échographie, avec des ondes
ultrasonores de haute fréquence (10-100 MHz), permet d’atteindre une résolution proche de 50 µm, jusqu’à
des profondeurs de quelques millimètres. Les méthodes optiques, en raison de la longueur d’onde de la
lumière beaucoup plus courte que celle des ultrasons, offrent une résolution potentielle très supérieure. La
microscopie confocale, notamment, est une technique d’imagerie tridimensionnelle de résolution sub-
micrométrique, aujourd’hui incontournable en biologie. La profondeur accessible est toutefois limitée à
quelques centaines de micromètres dans les tissus biologiques en raison de la forte diffusion de la lumière.
En outre, l’imagerie in vivo est difficile à cause des temps d’acquisition relativement longs et de la toxicité
de certains agents de contraste. La microscopie non-linéaire, développée récemment grâce aux progrès des
lasers à impulsion ultra-brèves (10-100 femtosecondes), permet d’améliorer la profondeur accessible en
raison d’une longueur d’onde d’excitation dans le proche infrarouge, généralement autour de 800 nm, où
l’absorption des tissus est minimale. L’utilisation de marqueurs fluorescents est toutefois généralement
nécessaire.
Figure 1 : Comparatif des performances des techniques classiques d’imagerie des milieux biologiques en termes de
résolution spatiale et de profondeur accessible. Source : D. Sampson

2
La tomographie par cohérence optique, communément désignée par l’acronyme anglais OCT (optical
coherence tomography), est une technique d’imagerie optique dont la première démonstration remonte à
vingt ans [Huang 1991]. L’OCT est analogue à l’échographie, à la différence que les ultrasons sont
remplacés par de la lumière. En mesurant le temps de parcours des ondes lumineuses réfléchies ou
rétrodiffusées par les structures internes d’un objet, il est possible de déterminer à quelles profondeurs se
situent ces dernières [Fercher 1996]. Des images en 2 voire 3 dimensions d’un objet semi-transparent
peuvent ainsi être obtenues en balayant le faisceau lumineux envoyé sur l’objet [Fujimoto 1995, Tearney
1996]. Le contraste des images OCT résulte des inhomogénéités de l’indice de réfraction au sein de l’objet.
La technique ne nécessite pas l’emploi d’agents de contraste. Elle est sans contact, contrairement à
l’échographie, et utilise de la lumière infrarouge inoffensive. La résolution spatiale de l’OCT, meilleure que
celle de l’IRM, de l’imagerie X, ou de l’échographie, s’approche de celle de la microscopie optique. Enfin la
profondeur d’imagerie accessible est supérieure à celle de la microscopie.
2. Principe de l’OCT
Si le concept de l’OCT est analogue à celui de l’échographie, ces deux techniques présentent toutefois
une différence fondamentale. En effet, à cause de la vitesse de la lumière, les variations de temps de parcours
ne peuvent pas être mesurées directement. En OCT, ces mesures sont effectuées de manière indirecte, par
corrélation, au moyen d’un interféromètre éclairé par de la lumière polychromatique. Le schéma du dispositif
expérimental de l’OCT classique est représenté sur la figure 1. Un interféromètre de type Michelson, à fibres
optiques, est éclairé par une source de lumière de spectre large. Cette lumière est séparée en 2 parties ; l’une
est envoyée dans le bras de référence et l’autre vers l’objet placé dans le deuxième bras de l’interféromètre.
A la sortie de l’interféromètre, des interférences se produisent à condition que la différence de longueur
optique des deux bras soit inférieure à la longueur de cohérence de la lumière. En faisant varier la longueur
du bras de référence (généralement par déplacement du miroir de référence), on peut sonder la profondeur de
l’objet. En effet, lorsque l’égalité des trajets optiques dans les 2 bras de l’interféromètre correspond à une
profondeur dans l’objet où se trouve une structure réfléchissante (ou rétro-diffusante), des interférences se
produisent (voir figure 2). En enregistrant l’amplitude des interférences au cours du déplacement du miroir
de référence, on peut accéder à la distribution des structures internes de l’objet en fonction de leur
profondeur. Ce « sondage » de la profondeur est réalisé à différents endroits dans l’objet en balayant le
faisceau lumineux. On obtient ainsi une image tomographique orientée perpendiculairement à la surface de
l’objet.
Figure 2 : Dispositif d’OCT classique. Le déplacement du miroir de référence permet de sonder la profondeur dans
l’objet tandis que le faisceau dans le bras objet est balayé. L’enveloppe du signal d’interférence détecté permet de
construire une image des structures internes de l’objet ayant réfléchi de la lumière.

3
Figure 3 : Illustration du principe de l’OCT. L’interférogramme, obtenu par balayage de la longueur du bras de
référence, permet après extraction de son enveloppe, de déterminer la profondeur d’une structure réfléchissante dans
l’objet avec une résolution donnée par la longueur de cohérence de la source lumineuse.
3. OCT fréquentielle
Récemment, une autre technique d’OCT a connu un développement spectaculaire : l’OCT fréquentielle
[Wojtkowski 2002, Nassif 2004]. Expérimentalement, la différence essentielle de l’OCT fréquentielle, par
rapport à l’OCT temporelle, est que le bras de référence de l’interféromètre a une longueur fixe (voir figure
3). Au lieu de faire varier sa longueur afin d’accéder à l’information en profondeur, on analyse le spectre du
signal d’interférence (d’où l’adjectif « fréquentielle »). On obtient ensuite l’information en profondeur par
calcul de la transformée de Fourier du spectre mesuré [Fercher 1995].
Considérons une structure réfléchissante à l’intérieur de l’objet. Le spectre de la lumière à la sortie de
l’interféromètre présente une modulation à cause des interférences de la lumière réfléchie par la structure
avec la lumière réfléchie par le miroir de référence. Ces interférences sont en effet périodiquement
constructives et destructives selon le nombre d’onde (inverse de la longueur d’onde) ; on dit que le spectre
est cannelé. La fréquence de cette modulation est proportionnelle à la différence de marche dans
l’interféromètre. La profondeur de la structure (par rapport à la position correspondant à la différence de
marche nulle) est donc directement donnée par la fréquence de modulation du spectre. La transformée de
Fourier du spectre donne trois composantes ; celle correspondant à la fréquence positive (fréquence de
modulation du spectre) indique donc la position de la structure. Ce pic est similaire à celui qui serait mesuré
en OCT temporelle par extraction de l’enveloppe des franges de l’interférogramme.
En pratique, l’objet possède une multitude de structures partiellement réfléchissantes (ou rétro-
diffusantes) situées à des profondeurs diverses ; le spectre mesuré présente alors une modulation complexe
résultant de la somme de modulations sinusoïdales de fréquences et amplitudes différentes. La transformée
de Fourier de ce spectre fournit la distribution en profondeur de toutes ces structures. Tout comme en OCT
temporelle, on peut sonder la profondeur de l’objet à différents endroits en balayant le faisceau lumineux et
obtenir ainsi des images tomographiques orientées selon l’axe du faisceau.
Figure 4 : Dispositif d’OCT fréquentielle à spectromètre. Le spectre du signal d’interférence, après transformée de
Fourier, fournit la distribution en profondeur des structures réfléchissantes dans l’objet.

4
Le principe de l’OCT fréquentielle présente un avantage intrinsèque par rapport à celui de l’OCT
temporelle en termes de rapport signal sur bruit [Choma 2003, Leitgeb 2003]. En effet, en OCT fréquentielle
toute la lumière provenant de l’objet contribue en permanence au signal. En OCT temporelle, en revanche, à
tout instant seule une faible partie de la lumière provenant de l’objet contribue aux interférences détectables ;
cette proportion de lumière utile est d’autant plus faible que la longueur de cohérence est petite. Grâce à cet
avantage, l’OCT fréquentielle permet de produire des images à grande vitesse avec une définition supérieure.
Il est même possible de produire des images en 3 dimensions à haute cadence.
Notons qu’il existe deux méthodes pour mesurer le spectre en OCT fréquentielle. Un spectromètre à
réseau, associé à une barrette de détecteurs, permet de mesurer le spectre en parallèle. Une autre technique
consiste à balayer la longueur d’onde de la source lumineuse et d’enregistrer l’intensité du signal
d’interférence en fonction de la longueur d’onde [Yun 2003]. Le balayage de la longueur du bras de
référence de l’OCT temporelle est ici remplacé par un balayage de la longueur d’onde. Ce dernier peut
toutefois être effectué très rapidement, ce qui ne limite pas la vitesse de production des images.
Figure 5 : Illustration du principe de l’OCT fréquentielle. Le spectre du signal d’interférence présente une modulation
dont la période dépend de la profondeur de la structure réfléchissante. La transformée de Fourier de ce spectre modulé
permet de connaitre la profondeur de la structure avec une résolution inversement proportionnelle à la largeur de
l’enveloppe du spectre, égale à la longueur de cohérence de la source lumineuse.
4. Résolution spatiale
L’une des particularités de l’OCT est que les résolutions transverse et axiale sont déterminées par des
paramètres indépendants : la résolution transverse est donnée par la taille du faisceau focalisé sur l’objet,
alors que la résolution axiale est déterminée par la longueur de cohérence de la lumière détectée. L’OCT
requiert donc une source lumineuse de spectre large, comme le montre la formule ci-dessous exprimant la
résolution axiale z en fonction de la largeur spectrale
et de la longueur d’onde centrale
de la lumière
de spectre supposé Gaussien, ainsi que de l’indice de réfraction n du milieu :
2
2ln2
zn
La source lumineuse doit en outre posséder une cohérence spatiale élevée pour que la valeur de
l’éclairement au niveau de l’objet permette un balayage rapide. Les diodes super-luminescentes, sources à
base de matériaux semi-conducteurs issues des technologies des télécommunications, sont bien adaptées pour
l’OCT ; elles offrent une résolution axiale de 10 à 15 µm au voisinage des longueurs d’onde de 800 nm ou
1300 nm typiquement. Depuis quelques années, beaucoup d’effort ont été réalisés pour améliorer la

5
résolution spatiale de l’OCT. Atteindre l’échelle de la cellule est important pour de nombreuses applications,
en particulier pour détecter les modifications de l’état de cellules susceptibles de donner lieu à des cancers.
Ces travaux ont largement profité des progrès récents réalisés dans le domaine des sources lasers et de
l’optique non linéaire. En 1999, une résolution de 1 micromètre a été atteinte avec un laser à base de titane
dopé au saphir émettant des impulsions de 5 femtosecondes, un record à l’époque [Drexler 1999]. Des lasers
constitués de fibres optiques amplificatrices de lumière ont également été utilisés. Une autre catégorie de
source lumineuse prometteuse est basée sur le phénomène non linéaire de génération de supercontinuum se
produisant dans les fibres dites à cristal photonique, fibres optiques dont le cœur contient des micro-canaux
d’air s’étendant continûment le long de leur axe [Wang 2003].
3. Applications de l’OCT
Ophtalmologie
L’OCT est aujourd’hui une technique standard en ophtalmologie, disponible commercialement.
Probablement aucune autre technique d’imagerie n’a été adoptée aussi vite par le milieu médical [Swanson
1993]. Seule technique permettant de visualiser les différentes couches constitutives de la rétine humaine in
situ, l’OCT est devenue un outil indispensable pour le diagnostic et le suivi de pathologies rétiniennes telles
que la dégénérescence maculaire liée à l’âge et la rétinopathie diabétique, pathologies représentant les
principales causes de cécité dans les pays industrialisés [Nassif 2004]. Un exemple d’image tomographique
de rétine saine, obtenue par OCT fréquentielle, est présenté sur la figure 6. Les dernières technologies
d’OCT permettent également de visualiser de nombreuses zones du segment antérieur de l’œil comprenant la
cornée, l’iris et le cristallin [Trefford 2008]. L’angle irido-cornéen, mesuré par l’OCT, est un paramètre
pertinent pour le diagnostic et le suivi du glaucome.
Figure 6 : Image OCT d’une rétine humaine présentant un trou maculaire.
Figure 7 : Image OCT du segment antérieur d’œil humain.
Médecine interne
La technologie de l’OCT, à base de fibres optiques, peut être facilement couplée à des systèmes optiques
conçus pour l’imagerie médicale interne [Yun 2006].
L’OCT est capable de révéler des modifications de la morphologie architecturale des tissus généralement
associées au développement de carcinomes. Pratiquée à l’aide d’un endoscope, l’OCT permet l’examen des
tissus superficiels des parois internes de l’œsophage et du colon afin d’y déceler des anomalies [Chen 2007,
Adler 2007]. Les performances actuelles de l’OCT ne permettent malheureusement pas encore d’établir un
diagnostic suffisamment fiable pour éviter de pratiquer une biopsie suivie d’un examen histologique. L’OCT
peut s’avérer néanmoins très utile pour repérer les zones suspectes in situ, réduisant ainsi le risque de
mauvais prélèvements.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%