UE 10– Tissu sanguin Guerin-Dubourg

UE 10– Tissu sanguin
Guerin-Dubourg
Date : 24/03/2017 Plage horaire : 16h15-18h15
Promo : P2 2016/2017 Enseignant : Guerin-Dubourg
Ronéistes :
PARIS Margaux
ESCULIER Mona
Pharmacologie de la pathologie thrombo-embolique
I.
Anticoagulant
1. Les héparines
2. Héparinoïdes
3. Nouveaux anticoagulants
4. Les AVK
II. Antiagrégants plaquettaires
1. Inhibiteur de l’amplification de TXA2
2. Potentialisateurs de l’AMPc
3. Les inhibiteurs du récepteur de l’ADP P2Y12
4. Les inhibiteurs du GPIIbIIIa activé
III. Annales

Introduction
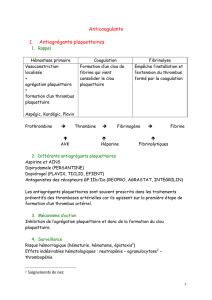
Petit rappel sur la coagulation :
Les pathologies thromboemboliques sont des pathologies qui sont liées à des troubles de la coagulation.
Il y a plusieurs mécanismes de coagulation :
- l’hémostase primaire (vasoconstriction et l'adhésion plaquettaire au vaisseau sanguin lésé et en
l'agrégation plaquettaire)
- l’hémostase secondaire ou coagulation (formation du caillot/agrégat plaquettaire en lui-même)
Le fibrinogène et les facteurs certain facteurs de coagulation sont contenus dans le sérum
Quand on parle de caillot de fibrine, c’est en fait une gélification du sérum (qui est normalement quelque
chose d’assez liquide), le thrombus étant l’agrégat plaquettaire qui se forme autour du caillot de fibrine.
Les maladies thromboemboliques correspondent à l’occlusion d’un vaisseau par un amas de cellules
(essentiellement des plaquettes) et/ou de fibrine. Les facteurs favorisants sont la stase, l’âge, les syndromes
d’hypercoagulabilité (risque familial de thrombophilie ; ex : déficit en facteur de coagulation), l’hyperten-
sion, l’hyperlipémie, les traitements d’œstrogène, les lésions/dysfonction de l’endothélium (souvent les
patients qui ont un fort risque cardiovasculaire avec une dysfonction endothélial associé vont avoir un
risque de thrombose artériel et veineuse plus important), toutes les formes de cancer qui vont avoir ten-
dance à activer la coagulation de façons assez anarchiques.
On va avoir deux types de thromboses : veineuses et artérielles. Ils vont dans les deux cas de figure faire
intervenir tous les processus de la coagulation (coagulation : caillot de fibrine ≠ agrégation plaquettaire :
plaquettes qui collent les unes entres les autres)
La thrombose veineuse avec trouble de la coagulation au niveau du sérum. On utilisera donc des anticoagu-
lants (héparine, nouveaux anticoagulants, AVK)
La thrombose artérielle avec agrégation plaquettaire et formation de thrombus (syndrome coronarien, chirur-
gie cardiaque). On utilisera ici des anti-agrégants plaquettaires.
Le mécanisme physiopathologique classique (mais ce n’est pas le seul) de la thrombose artérielle est la
plaque d’athérome. On parle d’athérosclérose, mécanisme inflammatoire au niveau des parois vasculaires
qui rigidifie les vaisseaux. On a une rupture de cette plaque d’athérome qui amène à un relargage de facteurs
de formation d’un agrégat de fibrine, mais surtout de formation de l’agrégat plaquettaire comme le calcium.
Cela amène à la formation d’un thrombus avec réseau de fibrine et plaquettes qui mènent à une occlusion, ce
qui entraine des pathologies comme l’IDM, l’AVC ou les artérites des MI.
Les grandes familles d’anti-thrombotique :
- Les anticoagulants qui vont limiter plutôt l’apparition de thrombose veineuse (héparine, nouveaux an-
ticoagulants, AVK)
- Les antiagrégants plaquettaires qui vont avoir vocation à prévenir la formation des thrombus artériel
- Les thrombolytique/fibrinolytique, qui sont des médicaments d’urgence qui visent à pulvériser/détruire
un caillot déjà formé (fibrinolyse), lors d’un AVC ischémique par exemple. Ce sont des médicaments à
utiliser avec énormément de prudence, les TVP peuvent amener à un déplacement du caillot et donner
des œdèmes aigue du poumon ou des ischémies au niveau du SNC
Dans ce cours nous ne traiterons que les anticoagulants.
Sérum : plus de fibrinogène (ce qui reste quand on a coagulé) ≠ Plasma
La coagulation est une cascade successive de facteurs de coagulations (thrombine, fibrinogène, fibrine) qui se
trouve dans notre plasma. Les facteurs de coagulations sont majoritairement de synthèse hépatique donc
quand vous avez une atteinte hépatique majeur, vous allez avoir des déficits de synthèse en facteur de coagula-
tion. Certains sont aussi vitamine K- dépendant, donc si vous prenez des traitements anti-vitamine K tous les
facteurs synthétisés par le foie mais qui dépendent aussi de la vitamine K dans leur synthèse vont diminuer (le
II, VII, IX, X).

La coagulation est un mécanisme de cascade enzymatique dont les éléments les plus importants sont le facteur
II et X, ce sont des cibles pharmacologiques privilégiées, et plus on agit en amont de la cascade de coagula-
tion, plus on aura un effet puissant. On a fait des tentatives pour agir plus haut, mais les risques hémorragiques
devenaient trop importants. Le facteur II va être activé par le facteur V et facteur Xa (X activé) pour donner le
facteur IIa (appelé thrombine) qui est capable de transformer le fibrinogène en fibrine (capacité de coagulation
par création d’un réseau de fibrine).
Les anticoagulants sont des médicaments qui vont agir sur cette cascade enzymatique, ce qui va in fine inhiber
la transformation du fibrinogène en fibrine.
A propos du test biologique, et pour résumer grossièrement : la TCA et la TCK explorent l’activité de l’hé-
parine alors que les INR explorent l’activité des AVK

I. Anticoagulants
1. Héparines
Les héparines sont des polysaccharides qui font partie des glycosaminoglycanes (répétitions d’unités dissa-
charidiques) et comportent des structures pentasaccharidiques qui portent la principale activité anticoagu-
lante. Elles sont présentes au niveau de l’endothélium et agissent en lien avec l’antithrombine en augmentant
sa capacité anticoagulante, c’est pour cela qu’on dit qu’elle a une activité indirecte : son activité est porté par
l’antithrombine, qu’elle potentialise. Les Héparine se donne forcément en sous cutané car étant constitué de
GAG elles se digèrent.
On distingue les HNF (héparines non fractionnées
avec PM moyen 15 000) qu’on extrait chez le porc, et les
HBPM (héparines de bas poids moléculaire avec PM < 8000)
qu’on obtient après fractionnement chimique ou digestion
enzymatique. Ces deux héparines portent les structures penta-
saccharidiques mais se distinguent par les chaînes. Les HNF
aux longues chaînes vont avoir une activité anticoagulante
supplémentaire non désirée car difficile à contrôler. Les
HBPM sont beaucoup plus courts, un peu moins puissantes
que les HNF, mais sont surtout plus facile à maîtriser.
Les héparines ont une activité anti-Xa indirecte. Elles vont agirent sur le Xa via l’anti-thrombine qui a la
capacité de se fixer au Xa et de l’inactiver. L’héparine elle agit sur la liaison entre l’anti-thrombine et le fac-
teur Xa, elle va la consolider. Donc plus de Xa, plus de génération de thrombine et donc plus de transformation
de fibrinogène en fibrine.
La chaine pentasaccharidique se lie directement à l’anti-thrombine. Cette chaine pentasaccharidique agit
comme un co-enzyme ou un activateur allostérique de l’AT donc quand il y a du pentasaccharide (de l’hépa-
rine) l’AT agit beaucoup plus facilement sur le Xa.

L’anti-thrombine (AT) est un facteur anticoagulant naturel qui agit principalement sur le facteur Xa mais qui
agit aussi sur la thrombine (facteur IIa). L’anti-thrombine liée à la thrombine, empêche son activité et donc la
transformation de thrombine et de fibrine.
Les HNF vont aussi avoir un effet dans la consolidation de la liaison entre l’AT et le facteur IIa. Donc activité
anti-Xa indirecte mais aussi activité anti-IIa indirecte via l’AT.
C’est la chaine oligosaccharidique de l’héparine qui va aussi avoir une activité anti-IIa quand elle est très
longue. ( ! Pas la chaine pentasaccharidique, juste la chaine oligosaccharidique).
Les HNF et les HBPM vont avoir une action identique sur le Xa via les pentasaccharidiques et l’anti-throm-
bine mais ont des capacités anti-coagulante totalement différentes puisque les HBPN n’ont pas de chaine
d’oligosaccharidique très longue et donc n’a pas d’activité anti-IIa.
Recap :
HNF :
- activité anti-Xa indirecte importante via chaine pentasaccharidique
- activité anti-IIa indirecte importante via la chaine oligosaccharidique
HBPM :
- activité anti-Xa indirecte importante via chaine pentasaccharidique
- pas d’activité anti-IIa si chaine trop courte. La liaison AT-IIa existe toujours mais le pentasaccharide
n’a pas d’effet.
S’il ne nous reste que le pentasaccharide, c’est ce qu’on appelle les héparinoïdes, on a une activité anti- Xa
seule indirecte.
L’activité du HNF anti-IIa on ne la maitrise pas bien, car elle varie en fonction de la taille de la chaine, des
patients et provoque beaucoup de variation thérapeutique d’un patient à l’autre. L’activé anti-Xa est mieux
maitrisé donc les HBPM sont mieux maitrisé.
! Il existe différentes HBPM, avec différentes longueurs de chaine et il est possible de retrouvé une petite
activité anti-IIa pour celle de plus haut PM
Il va y avoir des modifications qui sont lié a la relation structural de l’héparine et son activité, on aura donc des
rapports d’activité anti-Xa/ anti-IIa qui vont être différents.
Pour une HNF (héparine standard), on aura une activité anti-IIa et anti-Xa qui va être quasiment équivalente,
donc le rapport entre les deux sera de 1.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%