douleur aigue sommaire

Département de médecine communautaire de
premier recours et des urgenceService de
médecine de premier recours
DOULEUR AIGUE
SOMMAIRE
1. INTRODUCTION
2. MECANISMES
3. DIMMENSION BIO-PSYCHO-SOCIALE
4. EVALUATION
5. PRISE EN CHARGE
6. TRAITEMENT ET INDICATIONS
7. MEDICAMENTS ANTALGIQUES
8. TRAITEMENT DE LA DOULEUR CHEZ LES PATIENTS DEPENDANTS
DES OPIACES
9. LES POINTS IMPORTANTS A RETENIR
10. REFERENCES

HUG – DMCPRU – Service de médecine de premier recours Page | 2
DOULEUR AIGUË
1 INTRODUCTION
Selon l’association internationale pour l’étude de la douleur (IASP), la douleur est définie
comme « une expérience sensorielle et émotionnelle désagréable, associée à une lésion
tissulaire réelle ou potentielle ou décrite en des termes évoquant une telle lésion »1.
Une enquête menée au centre d’accueil et des urgences des HUG a montré que 80% des
patients consultant en urgence présentent une symptomatologie douloureuse et que la
prise en charge de la douleur aiguë est souvent lente et inadéquate. Des études
internationales montrent également que la douleur est encore insuffisamment identifiée
et prise en charge dans les centres d’urgences hospitaliers ou ambulatoires.
Les soignants considèrent souvent la douleur aiguë comme un signal d’alarme d’une
atteinte organique ou physiopathologique sous-jacente et ont tendance à privilégier la
recherche d’une cause physique identifiable. Il est en effet souvent postulé que si une
cause physique à l’origine de la douleur est identifiée et traitée, sa suppression aura un
effet antalgique. Dans l’intervalle, le patient continue d’avoir mal. De plus beaucoup de
professionnels de santé pensent qu’une antalgie administrée avant qu’un diagnostic
précis ne soit posé peut masquer les symptômes et nuire au processus diagnostique et
thérapeutique.2-5
Or, afin d’optimaliser et accélérer la prise en charge, les experts recommandent de
considérer la douleur comme une entité co-existante à toute maladie ou traumatisme
nécessitant une évaluation et une prise en charge parallèle.
2 MECANISMES
La douleur résulte d'une combinaison de facteurs physiologiques, pathologiques,
émotionnels, psychologiques, cognitifs, environnementaux et sociaux et couvre plusieurs
champs distincts tels que5.6:
1. la douleur nociceptive: un processus pathologique active au niveau périphérique le
système physiologique de transmission des messages nociceptifs. Cet excès de
stimulations nociceptives correspond au mécanisme le plus usuel de la douleur aiguë.
Exemples cliniques : traumatisme, inflammation, infection. Exemples sémiologiques :
douleur pulsatile, en coup de couteau, etc…
2. la douleur neurogène: douleur générée par des lésions dans le SNC ou SNP en
l'absence de stimulation de nocicepteurs périphériques. Exemples cliniques : zona,
polyneuropathie, névralgie, douleur post-AVC. Exemples sémiologiques : brûlures,
décharges électriques, fourmillements; hypoesthésie/anesthésie, allodynie/hyperalgie
à l’examen clinique
3. La souffrance: expérience multidimensionnelle (interne, morale, sociale ou
corporelle) qui entrave ou interrompt les possibilités de réalisation du sujet, limitant
ainsi son horizon d’existence, son « monde ». Dans notre société médicalisée, la
souffrance est souvent décrite en termes de douleur.
Le comportement douloureux constitue l’ensemble des manifestations verbales et non
verbales observables chez la personne qui souffre ; il s’agit de mots ou vocalisations, des
expressions faciales, des postures ou autres attitudes, donnant un aperçu de l’expérience
personnelle de la douleur. Les patients souffrant de douleurs aiguës présentent souvent
des attitudes antalgiques réactionnelles. Les patients souffrant de douleurs chroniques
médicalement inexpliquées peuvent fréquemment adopter des comportement antalgiques

HUG – DMCPRU – Service de médecine de premier recours Page | 3
que l’on peut considérer comme inadaptés tels que des boiteries persistantes ou une
inactivité marquée.
3 DIMENSION BIO-PSYCHO-SOCIALE
Le seuil de tolérance de la douleur est très variable d’un individu à l’autre et dépend en
grande partie de la perception par le patient de l’effet que la maladie ou le traumatisme
aura sur sa vie ainsi que de facteurs environnementaux et psychosociaux1,5-7. Les
soignants ont tendance à sous-estimer la gravité de la composante subjective de la
douleur ou du traumatisme et la détresse induite par la douleur. Or, les patients qui
consultent portent avec eux un cadre explicatif, un système de référence concernant
l’organe douloureux, le fonctionnement du corps et la thérapeutique. Ce que savent les
patients de leurs symptômes et le sens qu'ils leur attribuent est un élément important
dans l'expression de la douleur, la prise en charge de la douleur et la réponse au
traitement. Notamment, toute douleur liée à un événement accidentel, aussi minime soit-
il, doit faire l’objet d’une exploration soigneuse des circonstances de l’accident, du vécu
subjectif et du contexte socioprofessionnel. En effet, la menace sur l’intégrité corporelle,
l’impression de perte de contrôle sur son corps, la présence d’affects négatifs ainsi que la
précarité de certains emplois sont autant de facteurs de vulnérabilité qui peuvent
favoriser une évolution vers une douleur chronique si ceux-ci ne sont pas détectés et
légitimés dès le début de la prise en charge.
Outre les interventions pharmacologiques, les facteurs sociaux et relationnels sont
également fondamentaux dans la réponse du patient au traitement de la douleur. A cet
égard, le médecin lui-même doit être considéré comme un agent thérapeutique (effet
placebo). La nature, le caractère, la personnalité, le comportement et le style des
soignants influencent grandement la réponse des patients à l’administration de
médicaments inertes ou actifs. De même, on sait que la qualité de la communication
médecin-patient joue un rôle déterminant dans la gestion des problèmes de santé et le
contrôle de la douleur. La satisfaction du patient à l'égard de la prise en charge de la
douleur dépend également de l'importance accordée à la prise en charge de la douleur et
de la réponse donnée à ses attentes.
4 EVALUATION
Comme il n’existe pas de mesure objective de la douleur, l’évaluation de la douleur passe
par le questionnement du patient sur son expérience de la douleur. L'échelle visuelle
analogique (réglette EVA) est un instrument de mesure répandu et simple d’utilisation.
Bien que cette échelle ait été conçue pour évaluer l’intensité de la dimension sensorielle
de la douleur, on doit la considérer comme une intégration complexe de facteurs variés,
sensoriels mais également affectifs et cognitifs. Une évaluation plus complète de la
douleur peut se faire par l’administration du McGill Pain Questionnaire (MPQ).6,8
5 PRISE EN CHARGE
5.1 Evaluation1,5,6
• Evaluer la douleur comme le 5ème signe vital : mesurer et documenter la douleur de
manière visible dans le dossier médical et infirmier en utilisant l’échelle visuelle
analogique (EVA).
• Considérer le soulagement de la douleur aiguë comme une priorité.
• Eviter d’attendre la fin de la consultation et/ou d’éventuelles investigations qui se
prolongent avant de prescrire un antalgique

HUG – DMCPRU – Service de médecine de premier recours Page | 4
• Explorer les circonstances de survenue de la douleur, les représentations, attentes et
émotions du patient à l’égard de la douleur ainsi que les répercussions de cette
dernière sur le fonctionnement quotidien et les affects du patient.
5.2 Prescription1,5,6
• Informer le patient sur l’origine de la douleur, la nature de l’antalgie et les effets
escomptés.
• Dans le choix thérapeutique, s’inspirer des traitements qui se sont révélés efficaces
antérieurement chez le patient.
• Privilégier les formes orales, mais selon les attentes et les représentations du patient,
d’autres modes d’administration (im) peuvent se justifier. Eviter les suppositoires en
raison de l’absorption erratique par voie rectale.
• Rechercher les allergies et les contre-indications (relatives) aux (groupes de)
médicaments avant leur administration.
• Tenir compte d’éventuelles interactions médicamenteuses (p.ex. AINS et
anticoagulants ou glucocorticoïdes), en particulier pour les traitements prescrits pour
plusieurs jours.
5.3 Suivi1,5,6
• Réévaluer la douleur à intervalles réguliers et selon les interventions à but antalgique.
• A la fin de la consultation, donner un plan d’action pour la poursuite de la prise en
charge antalgique à domicile (posologies et horaires des médicaments, réserves,
contact médical). En fin de journée et durant les jours fériés, remettre au patient de
main à main plusieurs doses d’antalgie pour couvrir les premières 12 heures.
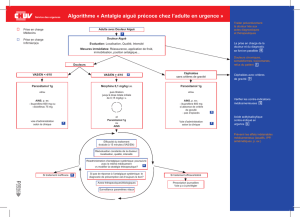
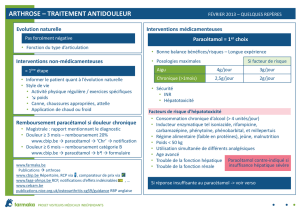
6 TRAITEMENT ET INDICATIONS
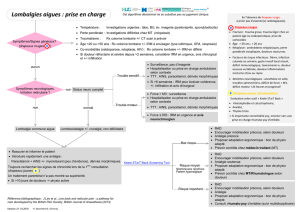
6.1 Lombalgies communes9-11
Prescrire la prise d’analgésiques à intervalles réguliers. On peut utiliser le paracétamol,
les AINS ou des opiacés faibles (comme le tramadol) (cf. stratégie « lombalgie aiguë »).
Les myorelaxants sont également efficaces pour soulager les douleurs lombaires aiguës.
Dans la majorité des cas, une combinaison de médicaments (avec des mécanismes
différents) sera privilégiée, une monothérapie devant plutôt être l’exception.
La supériorité de l’administration parentérale d’AINS sur la prise orale n’a pas été
démontrée. Une injection intramusculaire ou intraveineuse d’un AINS peut toutefois se
justifier en fonction des attentes et des convictions du patient.
Les opiacés puissants et les infiltrations lombaires n’ont normalement pas leur place dans
le traitement des lombalgies aiguës.
Le repos au lit strict n’est pas recommandé ; il faut encourager le patient à se mobiliser
selon ses douleurs. Il est utile de donner quelques conseils d’ergométrie (en particulier
pour se lever du lit ou ramasser un objet).
La physiothérapie active et les manipulations (dans des mains entraînées) ne sont pas
indiquées la première semaine mais peuvent être utiles si les plaintes se prolongent.
Il est important :
• de rassurer le malade sur le fait que s’il est bloqué ce n’est pas grave (il ne finira pas
en chaise roulante….) et de vérifier s’il n’y a pas d’autres croyances (par exemple :
c’est une hernie discale, je suis fichu, mon voisin a la même chose et ne travaille plus
depuis 3 ans…)

HUG – DMCPRU – Service de médecine de premier recours Page | 5
• de lui expliquer pourquoi on ne fait pas de radiographie (l’absence de radiographie est
source d’angoisse).
• d’expliquer que les médicaments ne feront pas forcément disparaître les symptômes
en quelques heures et qu’il faut persévérer 2 à 3 jours avant de consulter à nouveau,
sauf si des signes d’alerte apparaissent (fièvre, troubles sensitifs et/ou moteurs…).
6.2 Céphalées
Lors d’une crise aiguë de migraine, le traitement de premier choix est un anti-
inflammatoire associé à un gastrocinétique ou anti-émétique pris 15 minutes avant (cf.
stratégie ambulatoires « céphalées ». Les antagonistes des récepteurs 5-HT1 (suffixe : -
triptans) sont un traitement alternatif lors de crises réfractaires. Les antagonistes des
récepteurs 5-HT1 sont des vasoconstricteurs et sont à administrer prudemment chez des
patients coronariens et hypertendus.
Dans le cadre de céphalées de tension, l’administration d’un antalgique simple ou d’un
AINS peut s’avérer efficace.
Lors de céphalées en grappe, une oxygénothérapie 100% pendant 15 minutes (10L/min
au masque) ou l’administration d’un antagoniste des récepteurs 5-HT1 (-triptan) sont
indiquées.
Pour toutes les céphalées primaires, il convient de donner des conseils d’hygiène de vie :
(régularité dans les repas et le sommeil, exercice physique régulier, évitement des stress
et tensions, éviter le surdosage médicamenteux) rechercher et éviter les facteurs
déclenchants, favoriser l’approche comportementale.
Pour toute céphalée secondaire, l’administration d’antalgiques simples (paracétamol 1g)
est indiquée avant de procéder rapidement, si nécessaire, aux examens
complémentaires. En cas de suspicion d’hémorragie, les AINS sont à éviter en raison de
leur activité anti-aggrégante.
6.3 Douleurs abdominales
Lors d’une symptomatologie de reflux gastro-oesophagien (dont une manifestation est le
pyrosis qui peut être très douloureux), l’administration d’un inhibiteur de la pompe à
protons (IPP) constitue le traitement initial le plus efficace sur quelques jours (cf.
stratégies ambulatoires de la Policlinique de Médecine « dyspepsie »).
Lors de douleurs épigastriques sans signes de gravité (perforation, hémorragie active…),
il convient de proposer un traitement par un anti-H2 (moins puissant que les IPP mais
avec un effet plus rapide sur les brûlures d’estomac), à relayer éventuellement par un
IPP si la douleur persiste. On peut dans l’immédiat également ajouter du paracétamol (cf.
stratégie « dyspepsie »).
Dans le cas de douleurs abdominales crampiformes aspécifiques (par ex. dues à une
gastroentérite), l’association de paracétamol à un spasmolytique (comme la
butylscopolamine (Buscopan®) qui est très peu absorbé mais agit directement dans le
tube gastro-intestinal) est souvent efficace.
Les AINS sont le traitement de choix pour les coliques néphrétiques ; une restriction
hydrique est recommandée durant la crise (cf. stratégie « colique néphrétique »).
En cas de douleurs sus-pubiennes secondaires à une cystite aiguë, penser à ajouter des
AINS ou du paracétamol au début du traitement par antibiotiques.
Chez un patient difficilement examinable en raison de douleurs abdominales intenses, il
est tout à fait approprié de le soulager avec de la morphine par voie orale ou sous-
cutanée pendant la démarche diagnostique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%