Activité 2 (B4) : Comment extraire une espèce - cours

Activité 2 (B4) : Comment extraire une espèce chimique en solution ?
AVERTISSEMENT : Pour limiter les quantités utilisées de diiode et de cyclohexane, les manipulations seront faites avec de petits volumes
de solvant (1 mL
) dans des tubes à essais.
Afin de préparer le dosage des ions cuivre Cu2+ dans une solution, des étudiants étudient la réaction entre une
solution aqueuse contenant les ions cuivre et une solution aqueuse d’iodure de potassium (K+ + I–).
La solution aqueuse obtenue est constituée d’un mélange de solides bruns (diiode I2 et iodure de cuivre CuI),
d’ions cuivre Cu2+ en excès et d’ions potassium K+.
Le technicien de laboratoire qui récupère la solution doit effectuer un tri des déchets. En effet, le diiode I2 doit
être séparé des ions cuivre Cu2+ pour être collecté dans le bidon approprié avant d’être expédié au centre de
traitement des déchets.
Comment le technicien de laboratoire doit-il procéder pour séparer les ions cuivre Cu2+ du
diiode I2 ?
Données :
Ethanol C2H6O
Cyclohexane C6H12
Irritant pour la peau
Densité : d = 0,78
ébullition = 78 °C
Densité : d = 0,79
ébullition = 81 °C
Miscibilité avec l’eau : totale, en toute proportion
Miscibilité avec l’eau : nulle
Diiode I2
Nocif par contact cutané
Densité : d = 4,9
fusion= 114 °C ;
ébullition = 184 °C
Solubilité dans l’eau : faible (0,3 g.L–1)
Solubilité dans le cyclohexane : moyenne (21 g.L–1)
Solubilité dans l'éthanol : grande (170 g.L–1)
Travail à faire
Q1) Vérifier les propriétés de miscibilité – de l’eau dans l’éthanol,
– de l’eau dans le cyclohexane
– de l’éthanol dans le cyclohexane
Q2) Vérifier qualitativement les propriétés de solubilité du diiode I2 dans l’eau, l’éthanol et le cyclohexane (utiliser une petite
pointe de spatule de diiode, à ne pas toucher avec les doigts). Noter vos observations.
Q3) Proposez un protocole expérimental pour extraire le diiode de la solution aqueuse contenant le mélange d’ions cuivre,
de précipité d’iodure de cuivre et de diiode et le faire passer en phase organique (justifier le choix du solvant organique).
Q4) Faire l’expérience et compléter les schémas avant et après ajout du solvant organique de l’ampoule à décanter.
Conclusion
Pour extraire une espèce chimique, on peut ajouter un solvant dans lequel l’espèce à extraire est
………………………………… que dans le solvant initial.
Le solvant ajouté et le solvant initial doivent être ………………..………………… : on peut ainsi les séparer en
utilisant …………………………………….
Prolongement.
Expliquer, avec les notions de polarités, les propriétés de miscibilité entre l’eau, l’éthanol et le cyclohexane et la solubilité du
diiode dans l’eau et le cyclohexane. Quel problème pose la solubilité entre le diiode et l’éthanol ?
Equilibrer la réaction de présentation … Cu2+
(aq) + … I–
(aq) … CuI (s) + … I2 (aq)
Etablir le tableau d’avancement de cette réaction et le remplir avec n0(Cu2+) = 2,0.10–2 mol et n0(I– ) = 5,0.10–2 mol.
C
Ca
ap
pa
ac
ci
it
té
és
s
t
tr
ra
av
va
ai
il
ll
lé
ée
es
s
:
:
REA1 - Réaliser un schéma normalisé ATT3 – Travailler en équipe
REA2 – Suivre un protocole et/ou choisir le matériel adapté. REA3 – Respecter les règles de sécurité.
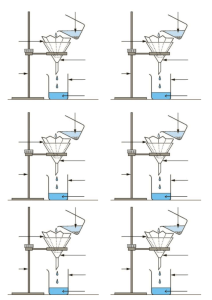
Après agitation et décantation
faire un schéma du résultat de chaque
manipulation avec les phases observées :
aqueuse et organique.

cyclohexane
eau
Activité 2 (B4) : Comment extraire une espèce chimique en solution ?
Q1) Miscibilité entre solvants
Q2) Solubilité du diiode :
Q3) Protocole complet :
- Filtrer le mélange de solides et de liquides.
CuI est le résidu (reste dans le filtre) et I2 et Cu2+ sont dans le filtrat
- Extraire le diiode avec le cyclohexane.
Introduire dans l’ampoule à décanter le filtrat,
Ajouter dans l’ampoule à décanter 5 mL de cyclohexane (prélevé sous
la hotte avec une éprouvette graduée)
Boucher l’ampoule à décanter et agiter (ouvrir le robinet pour
dégazer)
Laisser décanter les liquides non miscibles (ampoule sur support,
enlever le bouchon)
Recueillir les 2 phases dans 2 béchers (ici phase aqueuse en bas).
-
Procéder à une autre extraction (pour extraire complètement le diiode de la
phase aqueuse).
cyclohexane
diiode
eau
diiode
éthanol
diiode
éthanol
eau
cyclohexane
éthanol
1 seule phase : les 2 espèces sont miscibles
Phase organique (cyclohexane) : la moins dense
Phase aqueuse (eau) : la plus dense
1 seule phase
Faible coloration jaune (le diiode est peu soluble dans l’eau)
Forte coloration violette (le diiode est moyennement soluble dans le
cyclohexane)
Coloration jaune-orangé (le diiode est très soluble dans l’éthanol)

Q4)
Conclusion
Pour extraire une espèce chimique, on peut ajouter un solvant dans lequel l’espèce à extraire est plus soluble que
dans le solvant initial.
Le solvant ajouté et le solvant initial doivent être non–miscible : on peut ainsi les séparer en utilisant une
ampoule à décanter.
Prolongement :
Expliquer, avec les notions de polarités, les propriétés de miscibilité entre l’eau, l’éthanol et le cyclohexane et la solubilité du diiode
dans l’eau et le cyclohexane. Quel problème pose la solubilité entre le diiode et l’éthanol ?
L’eau est un solvant polaire.
L’éthanol est un solvant qui possède un coté polaire (le côté avec OH) et une chaîne carbonée non polaire.
Le cyclohexane est un solvant apolaire.
Des solvants polaires se mélangent bien entre eux et des solvants apolaires se mélangent bien entre eux.
Ainsi l’eau et l’éthanol sont miscibles, l’eau et le cyclohexane sont non miscibles et l’éthanol et le cyclohexane sont miscibles.
Le diiode est un soluté apolaire.
On comprend ainsi qu’il est soluble avec le cyclohexane (car c’est un solvant apolaire) et très peu soluble avec l’eau (qui est un solvant
polaire). Mais le diiode est très soluble avec l’éthanol (qui est en partie polaire), ce qui semble contredire la règle.
A ne pas savoir : En fait, le diiode réagit avec l’éthanol (il s’oxyde) pour former un composé appelé complexe de formule I3
– . Ainsi ce
composé (polaire) peut se mélanger très bien avec l’éthanol polaire.
Equilibrer la réaction de présentation … Cu2+
(aq) + … I–
(aq)
… CuI (s) + … I2 (aq)
2 Cu2+
(aq) + 4 I–
(aq) 2 CuI (s) + I2 (aq)
Etablir le tableau d’avancement de cette réaction et le remplir avec n0(Cu2+) = 2,0.10–2 mol et n0(I– ) = 5,0.10–2 mol.
Etat du
système
Avancement
2 Cu2+ (aq) + 4 I- (aq) 2 CuI (s) + I2 (aq)
Etat initial
x=0
n0(Cu2+)
n0(I-)
0
0
En cours
x
n0(Cu2+) - 2x
n0(I-) - 4x
2x
x
Etat final
xmax
n0(Cu2+) - 2xmax
n0(I-) - 4xmax
2xmax
x
La réaction s’arrête quand
il n’y a plus de Cu2+
n0(Cu2+) - 2xmax =0
xmax = n0(Cu2+)
2 = 2,0.10–2
2 = 1,0.10–2 mol
il n’y a plus de I–
n0(I–) - 4xmax =0
xmax = n0(I–)
4 = 5,0.10–2
4 = 1,3.10–2 mol
Donc xmax = 1,0.10–2 mol
nf(Cu2+) = 0
nf(I–) = n0(I-) - 4xmax = 5,0.10–2 – 4x1,0.10–2 = 1,0.10–2 mol
nf(CuI) = 2xmax = 2x1,0.10–2 = 2,0.10–2 mol
nf(I2) = xmax = 1,0.10–2 = 1,0.10–2 mol
Après agitation et décantation
Filtrat contenant le
diiode I2 et les ions
cuivre Cu2+
Cyclohexane incolore
Cyclohexane violet
contenant le diiode
incolore (phase
organique)
Filtrat contenant les ions cuivre
Cu2+ et beaucoup moins de
diiode (phase aqueuse)
1
/
3
100%