Il faut connaître les schémas, le texte sert seu

Ravalet Noémie Mr Chevalier
Forget Julie Biochimie
28/09/2010
/!\ Exam /!\ : Il faut connaître les schémas, le texte sert seulement de support. Il faut
connaître les principales formules (ex : formule du glucose et de l’alanine dans le cycle
glu/ala), et connaître le contexte de cette figure/schéma. 4 à 6 questions avec une ½ page pour
répondre. Plus de baratin.
Nos remarque seront faites en gras.
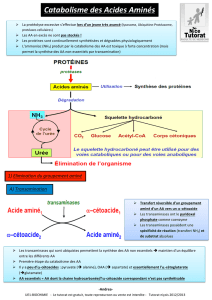
4.1 - SYNTHESE DU CARBAMYLPHOSPHATE
Dans les mitochondries, la carbamylphosphate synthétase utilise le CO2 (sous la forme
d’ion bicarbonate en solution aqueuse HCO3-), le NH3 et 2 ATP pour former le
carbamylphosphate (voir aussi la biosynthèse des nucléotides). Plusieurs étapes : 2 liaisons
riches en énergie sont consommées : irréversible.
Attention ! La figure est fausse !
Récapitulatif : la synthèse du carbamylphophate se fait en trois étapes :
-1) Le CO2 est sous forme de bicarbonate :
Bicarbonate (HCO3-) + ATP → Carboxyphosphate ( COOH-O-(PO3)2-) + ADP .
Cela correspond à la charge d’un groupement phosphate sur le bicarbonate.
-2) Carboxyphosphate + NH3 → Acide carbamique ( COOH-NH2) + Pi .
(NH3=ammoniaque et non NH4 !!)
L’acide carbamique est un acide aminé car il possède un groupement acide et un
groupement amine. Le groupement phosphate du carboxyphosphate est relargué, et
NH2 vient se fixer sur COOH.
-3) Activation de l’acide carbamique :
Ac. Carbamique + ATP → Carbamylphosphate ( NH2-CO-O-(PO3)2- ) + ADP
La carbamyl-phosphate synthétase I, mitochondriale, participant à l'uréogénèse, est
différente de la carbamyl-phosphate synthétase II, cytoplasmique, participant à la synthèse
des nucléotides pyrimidiques (isoenzymes).
1

Elle catalyse la condensation d'un ion bicarbonate avec l'ammoniac en carbamate
(NH2-COOH), puis elle active ce carbamate en carbamyl-phosphate. Le coenzyme ATP sert
de donneur d'énergie et de phosphate. L'hydrolyse de l'ATP libère des protons dans la matrice.
Explication résumée du schéma : Le cycle de l’urée (correspond à l’élimination des
groupements azotés)
Il est divisé en deux parties : une partie dans la mitochondrie et la deuxième dans
le cytosol.
Dans la mitochondrie : (les chiffres correspondent aux numéros du schéma)
- (2) Condensation du carbamyl-phosphate et de l’ornithine (qui est un acide aminé).
Cette réaction se fait par l’intermédiaire de l’enzyme ornithine transcarbamylase. Le
produit obtenu est la L-citrulline. La citrulline correspond à l’assemblement de la
chaîne de l’ornithine avec le groupement CO-NH2 du carbamyl-phosphate. Il y a donc
un potentiel de 3 azotes sur la citrulline. L’orthophosphate (pi) du carbamyl-phosphate
est relargué. La citrulline a la capacité de traverser la membrane mitochondriale pour
aller dans le cytosol
- (3) Modification de la citrulline : dans le cytosol.
Condensation de la citrulline avec un aspartate grâce à l’argininosuccinate synthase. Le
produit est l’argininosuccinate. C’est une réaction fortement consommatrice d’énergie,
l’ATP perd son pyrophosphate (PPi). Le groupement azoté de l’aspartate va venir se
fixer à la place de C=O de la citrulline : réaction d’élongation de la molécule.
- (4) Le groupement azoté de l’aspartate reste fixer sur l’argininosuccinate et il y a
relargage d’une partie de la molécule qui donne le fumarate. L’enzyme catalysant la
réaction est l’argininosuccinate lyase.
2

La différence entre la citrulline et l’arginine se situe au niveau de la double
liason : l’arginine a un groupement C=NH2+ tandis que la citrulline a un groupement
C=O. L’arginine regroupe donc 2 azotes dans un élément détachable.
Il faut retenir également qu’il y a une entrée d’aspartate et une sortie de
fumarate, le nombre de carbones est le même.
Il y a une forte consommation d’énergie, c’est un effort pour la cellule. Toutes ces
étapes permettent la synthèse de l’arginine.
Ensuite, il faut se souvenir que le fumarate a un lien avec le cycle de Krebs et que
l’aspartate peut être transformé en oxalo-acétate, permettant de faire le lien avec la
néoglucogenèse.
Le cycle de l’urée est riche en interactions avec d’autres voies métaboliques.
- (5) : L’arginine est hydrolysée par l’arginase avec production d’une molécule d’urée à
2 azotes. Il y a en même temps reformation d’ornithine capable de re-rentrer dans la
mitochondrie, et de débuter un nouveau cycle.
4.2 – SYNTHESE DE LA CITRULLINE
Sous l'action de l'ornithine transcarbamylase, le radical carbamyle est transféré sur
l'ornithine pour former la citrulline.
Ornithine + carbamylphosphate → Citrulline + Pi
PHASE CYTOSOLIQUE
4.3 - FORMATION DE L'ARGININOSUCCINATE.
La citrulline obtenue est transportée dans le cytosol. Sous l’action de l'argininosuccinate
synthétase, la citrulline se condense avec l'aspartate (fournit l’autre atome azoté de l’urée)
pour donner l'argininosuccinate avec consommation de 2 liaisons phosphates riches en
énergie d'un ATP.
Citrulline + Aspartate + ATP → Argininosuccinate + AMP + PPi
4.4 – FORMATION DE L’ARGININE
Elle est catalysée par une argininosuccinate lyase qui assure le clivage en arginine et en
fumarate. Cette réaction intervient aussi dans la biosynthèse de l'arginine.
Argininosuccinate → arginine + fumarate
4.5 - HYDROLYSE DE L'ARGININE
L’hydrolyse de l’arginine termine le cycle. Il se forme de l’urée et de l’ornithine. La
réaction est catalysée par l’arginase
3

Alors que l’urée est excrétée pour être éliminée par l’urine, l’ornithine est transportée
dans les mitochondries pour réinitier le cycle.
L’arginine est clivée par l’eau, l’urée est relarguée, il reste un groupement NH
maintenu pour faire l’ornithine.
Rq « hors cycle de l’urée » cf anabolisme de l’arginine – synthèse de créatine (conjugaison
arginine, glycine, méthionine)
L’arginine peut entrer dans un autre processus : la condensation avec la glycine
(=glycolle NH2-CH2-COOH), qui permet la formation de Glycocyamine (porte 3 azote).
L’intérêt est la synthèse de la créatine par un certain nombre d’étapes. Rappel : la
phosphocréatine est une molécule très riche en énergie, qui peut suppléer à l’ATP
pendant les premières secondes d’un effort musculaire important. Donc, à partir
d’acides aminés classiques on est capable de produire des dérivés riches en énergie.
BILAN DU CYCLE
NH3 + HCO3- + Aspartate + 3 ATP + 2H2O→ Urée + Fumarate + 2 ADP + AMP + 2 Pi + PPi
Au cours de la formation d'une molécule de l'urée 4 liaisons riches en énergie ont été
utilisées (2 ATP en 2 ADP+ 2 Pi, ATP en AMP + PPi). Mais le fumarate est transporté dans
les mitochondries et repris par le cycle de l’acide citrique qui l’oxyde en oxaloacétate. Ce
dernier sera transaminé en aspartate par l'aspartate aminotransférase ou converti en glucose
par gluconéogenèse. Un lien entre le cycle de l’urée, le cycle de l’acide citrique et la
gluconéogenèse (synthèse d’ATP, NADPH, H+).
4

Récapitulatif :
-synthèse du carbamylphosphate
-condensation du carbamylphosphate avec ornithine
-phase cytoplasmique avec arginino-succinate et arginine
-l’urée ressort du cycle
Il y a un lien avec le cycle de Krebs : intégration de l’aspartate, et relargage du
fumarate. Le fumarate est transformé en malate, puis oxalo-acétate.
Sur l’oxalo-acétate ( -OOC-CH2-CO-COO-), il y a une étape de transamination avec
d’autres acides amines (aas). La transaminase est capable de fixer un autre groupement
azoté sur la liaison C=O DE L’OA (oxalo-acétate). On se retrouve alors avec de
l’aspartate. L’OA est le deuxième composé de la néoglucogenèse et on remonte vers le
glucose.
Conclusion :
Le cycle de L’urée, la néoglucogenèse et la transamination de l’OA sont liés par
l’aspartate et le fumarate. Il y a un lien intime entre le métabolisme des aas et celui des
sucres.
Les tissus exportent l’azote vers le foie
Nous avons vu que l’essentiel de la dégradation des AA intervient dans le foie mais le muscle
squelettique peut utiliser les AA dans le cas exercice prolongé et jeûne à travers : Le cycle
glucose–alanine du muscle squelettique.
(1) dégradation du glycogène (2) glycolyse (3) cycle de l’acide citrique, source d’énergie :
acides aminés (4) phosphorylation oxydative – l’azote est transféré sur l’alanine via
glutamate - (5) gluconéogenèse (6) cycle de l’urée
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%