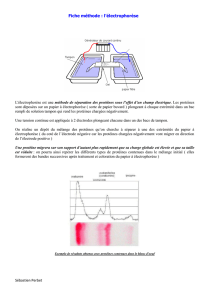
TD de Biochimie 4 : Electrophorèse.

TD de Biochimie 4 :
Electrophorèse.
Synthèse de l’expérience 1
Les questions posées durant l’expérience 1
Exposé sur les méthodes de séparation des
molécules :
Paramètres de séparation
Méthodes : l’électrophorèse (et les autres).

Questions
• Quel est l’effet de la variation de la
concentration d’agarose ou d’acrylamide sur la
résolution d’un gel d’électrophorèse ?
• A quoi sert le préchauffage d’un gel
dénaturant, pour les acides nucléiques ?
• Quelle est la direction de la migration des
protéines dans un courant électrique ?

Rappel : Structure des acides nucléiques
Le nombre de charges est proportionnel au
poids moléculaire (~longueur) des fragments.
- - - -
-
-
ADN
Chargés négativement
(groupes phosphates)
1 ou 2 brins
Complexe
(p.ex. ARNr)
Circulaire
(p.ex. plasmide)
Linéaire
(p.ex. fragment
de restriction)

(Rappel :) Structure des protéines
Phosphorylation
(Ser, Thr, Tyr)
Pont
disulfure
(Cys) Aa hydrophobes
Glycosylation
(Asn, Ser, Thr)
Oligomerisation
Membranaires
Mitochondriales
Nucléaires
Cytoplasmiques
Vésiculaires
Sécrétées

Principaux paramètres de séparation des
molécules :
•Charge
•Poids moléculaire et Forme
Densité
• Solubilité
• Affinité
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%