Électrophorèse

S. I. I.T.U. B.
ELECTROPHORESE
GENERALITES
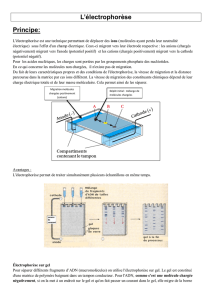
Les molécules chargées migrent vers leur électrode respective: celles qui sont
chargées négativement, les anions, migrent vers l'anode; celles qui sont chargées
positivement, les cations, migrent vers la cathode; celles qui ne sont pas chargées,
neutres, ne migrent évidemment pas. On parle ici évidemment de charge nette, toutes
les protéines contenant des acides aminés ayant des chaines latérales contenant des
groupes fonctionnels ionisés.
On peut caractériser la migration par la vitesse à laquelle la molécule se déplace et la
distance qu'elle parcourt. Ces deux facteurs s'influencent évidemment un l'autre.
PRINCIPES DE BASE
Migration et conditions physico-chimiques
Le courant électrique, généralement mesuré en mA, influe sur la migration. Plus le
courant est intense plus la migration se fera vite (et loin).
L'intensité du champ électrique (tension ou voltage), généralement mesurée en V,
affecte l'intensité du courant. Dans un système où la résistance (r) est constante, il y a
un lien direct entre la tension ("voltage", V) et le courant (I); il s'agit évidemment de
l'équation de base de l'électricité:
V = r * I
Donc en modifiant le courant on modifie aussi la tension et inversement. La résistance
n'est cependant pas stable au cours d'une électrophorèse, elle a généralement tendance
à diminuer avec le temps.
La résistance électrique du système résulte directement de la concentration des
électrolytes dans le tampon d'électrophorèse. À courant et à voltage donnés, plus la
concentration d'électrolytes sera forte, plus le courant sera du à ces électrolytes et non
pas aux molécules de l'échantillon qu'on veut séparer. Donc, plus la résistance du
système, due aux ions présents dans le tampon et la matrice, est forte, plus la
migration des molécules de l'échantillon sera lente. Il faut quand même qu'il y ait des
électrolytes dans le système pour soutenir le passage du courant. Ils servent aussi à
maintenir des conditions de pH et de force ionique pour que la séparation se fasse et
que les molécules à séparer restent stables et solubles.

Migration et caractéristiques des molécules
La charge des molécules est évidemment la caractéristique fondamentale de la
migration électrophorétique. Elle détermine la direction d'après sa polarité, vers
l'anode ou la cathode, et la vitesse, donc la distance, de migration proportionnellement
à la densité de la charge.
Normalement la charge d'une molécule est dépendante du pH du milieu, c'est le cas de
la plupart des molécules biologiques. Pour une molécule ayant plusieurs groupements
ionisables, il faut évidemment ternir compte de sa charge nette. La charge nette
dépend du pI (pour une protéine) et du pH du milieu ambiant. (Reviser au besoin ces
concepts de pI vs pH vs charge nette d'une protéine ou d'un acide aminé)
La taille des molécules a une certaine influence, particulièrement dans le cas où les
molécules passent à travers une matrice poreuse. Plus la taille des molécules est
petite, relativement à celles des pores, plus les molécules se déplaceront facilement,
ce qui implique évidemment qu'elles migreront rapidement. La taille peut donc avoir
une importance majeure dans une électrophorèse. Elle peut même devenir la base sur
laquelle on sépare les molécules, particulièrement dans le cas des macromolécules si
le montage expérimental est conçu à cet effet. La taille des macromolécules peut aussi
avoir un effet indirect puisque qu'elle est liée au nombre de charges, à sa surface de
contact avec le solvant ou la matrice, etc.
L'affinité des molécules pour la matrice affecte la migration. Plus l'affinité est grande
moins la molécule migre vite et loin, parce qu'elle est retardée. Ce phénomène étant
généralement nuisible à la qualité de la séparation et la vitesse de la migration, on
essaie de minimiser ce problème en choisissant des matrices les plus inertes possibles
(acrylamide) par rapport aux molécules qu'on veut séparer. Cependant on peut tirer
parti d'une telle affinité qui constituera un des éléments de séparation des molécules.
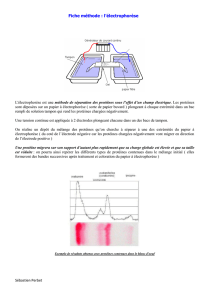
Ainsi la séparation des protéines sériques par électrophorèse sur acétate de cellulose
ou sur papier tire profit du fait que certaines classes de protéines ont des affinités
différentes pour ce support, en plus de différences de densité de charge. Par exemple,
on peut séparer les classes de protéines sériques (albumine vs a-globulines vs b-
globulines vs g-globulines) par électrophorèse sur acétate de cellulose.
APPAREILS ET METHODOLOGIE
De nos jours, on n'utilise que des matrices solides pour supporter l'échantillon à
analyser, c'est ce qu'on appelle une électrophorèse de zone. En effet les fractions
séparées migrent comme des "zones" individuelles. Plusieurs types de matrice solide
sont utilisés pour permettre le déplacement de l'échantillon. Il y a celles sur lesquelles
la migration se fait à la surface: papier, acétate de cellulose, etc. On a aussi celles qui
forment un gel poreux permettant la migration à l'intérieur même de la matrice:
agarose, polyacrylamide, etc. Plusieurs facteurs influenceront la vitesse de migration
(donc la séparation) des molécules durant une électrophorèse. Tout d'abord on peut
mentionner la charge qui est dépendante, pour une protéine, de son point isoélectrique
et du pH milieu. L'affinité de la protéine pour la matrice peut avoir un effet très
important, comme dans le cas des électrophorèses de macromolécules sur acétate de
cellulose ou sur papier. Dans le cas d'un gel poreux, la taille de la protéine peut avoir

une importance primordiale car les mailles ("pores") du gel peuvent ralentir le
déplacement des grosses molécules. Il existe même des cas où la seule variable qui
déterminera la séparation sera justement la taille, comme dans l'électrophorèse en gel
d'acrylamide-SDS. La résolution des échantillons dépendra de la méthode utilisée.
Les protéines pourront être séparées de façon individuelle, comme dans le cas de
l'électrophorèse en gel d'acrylamide-SDS. Certains autres types d'électrophorèse,
comme celle sur acétate de cellulose, ne permettront qu'une séparation en groupes
plus ou moins définis de protéines.
Montage horizontal
Ce genre de montage est surtout utilisé pour les matrices comme l'acétate de cellulose
ou le papier où les échantillons se déplacent à sa surface. La matrice est sous forme de
bande (de papier ou d'acétate de cellulose) longue et généralement étroite.
Les deux bouts de la matrice plongent dans un tampon d'électrode (solution
d'électrolytes) ce qui permet de créer une mince couche d'eau à sa surface. Dans cette
mince couche, les ions se déplacent à la surface, créant le courant qui entraînera les
diverses molécules de l'échantillon qui migreront suivant leur charge. Cet échantillon
est déposé sur la matrice.
On utilise aussi des montages horizontaux pour des matrices d'agarose lors de
l'électrophorèse d'acides nucléiques ou d'immuno-électrophorèse.
Montage vertical
Ce genre de montage est surtout utilisé pour les matrices comme les gels de
polyacrylamide ou, plus rarement, d'agarose. Les échantillons se déplacent
généralement à l'intérieur de la matrice.
La matrice est sous forme de matériel gélifié, entre deux plaques de verre ou, plus
rarement de nos jours, dans un tube cylindrique. Elle est souvent préparée peu avant
usage en formant un "sandwich" plaque de verre/gel/plaque de verre ou une "carotte"
à l'intérieur du tube de verre. Durant la gélification on aura pris soin de faire des puits
où on déposera des échantillons. Chaque extrémité du gel sera mise en contact avec
un tampon contenant des électrolytes qui, soumis dans à un potentiel électrique,
permettra la propagation d'un courant dans le gel. Ce courant entraînera les molécules
constituant l'échantillon. Cette migration permettra la séparation des diverses espèces
moléculaires qui migreront à des vitesses différentes.
Il s'agit généralement de gel d'acrylamide puisque cette substance peut s'attacher sur
le verre et ne glissera pas hors du "sandwich". Par contre l'agarose ayant une faible
affinité pour le verre se prête mal à ce genre de montage.
On peut en général contrôler les facteurs d'ordre électriques par le réglage de la source
du champ électrique (e.g. tension ou courant), la composition des tampons (résistance
du système de tampon). Certains facteurs sont cependant plus difficiles ou
impossibles à contrôler (e.g. affinité pour la matrice).
Principales matrices d'électrophorèse
La matrice d'une électrophorèse est le support physique sur lequel ou dans lequel
l'échantillon sera déposé et ses molécules migreront. Cette matrice peut soit, être
fabriquée d'avance et utilisée telle quelle, soit faite immédiatement avant usage. Il y a

plusieurs types de matrices qui diffèrent au niveau de leur constitution (matériel avec
lequel elles sont faites), du type de montage dans lequel elles sont utilisées et leurs
caractéristiques physico-chimiques.
Papier: Habituellement employé dans un montage horizontal, plus rarement vertical, il
servait surtout à séparer des acides aminés ou d'autres petites molécules chargées. Le
dépôt et la migration des échantillons se font en surface. La présence de charges sur la
cellulose qui constitue le papier interfère un peu avec la migration. Il est de moins en
moins utilisé sauf, quelques fois, pour la séparation des acides aminés sous très haut
voltage.
Acétate de cellulose: Il s'agit d'un dérivé acétate d'une forme purifiée de cellulose.
Elle se présente sous la forme d'une mince et fragile feuille. Le dépôt et la migration
se font en surface sur un montage horizontal. On s'en sert beaucoup pour séparer
grossièrement des protéines. La faible résolution ne permet que la séparation de
grands groupes de protéines. Son faible coût et sa grande facilité d'emploi la rendent
utile pour la séparation des protéines sériques, particulièrement en biochimie clinique
pour le diagnostic de maladies. Mais même dans ce secteur, on le remplace par des
méthodes où la matrice est de l'agarose.
Polyacrylamide: On peut polymériser l'acrylamide entre deux plaques de verre ou à
l'intérieur de tubes cylindriques de verre, où il formera un gel poreux. On dépose
l'échantillon sur le sommet du gel de polyacrylamide, maintenu vertical. Les
molécules pourront alors migrer à l'intérieur de ce gel. Cette matrice électriquement
inerte n'entrave pas la migration, permettant donc des séparations de haute résolution.
Les gels de polyacrylamide servent couramment à séparation des protéines. Ils sont
aussi souvent employés pour les acides nucléiques de petite taille, particulièrement
dans le séquençage.
Agarose: Cette substance très hydrophile peut même à très basse concentration, de
l'ordre de 1%, former des gels solides mais très poreux. L'agarose ne polymérise pas
par création de liens covalents, il se gélifie à basse température. Cette gélification est
due à la formation d'une multitude de liens hydrogène entre les longues molécules
linéaires de dextran qui composent l'agarose. Sa faible adhésion au verre oblige
généralement à étaler ce gel sur une plaque de verre maintenue horizontale. Sa grande
porosité le rend très utile pour séparer les molécules ou les complexes moléculaires de
grande taille. C'est la matrice très souvent utilisée pour l'électrophorèse des acides
nucléiques. Les immuno-électrophorèses sont aussi faites sur gel d'agarose. De plus
en plus, on utilise cette matrice pour la séparation des protéines sériques. Les
laboratoires de biochimie clinique utilisent des versions automatisées avec des
cassettes de gel d'agarose souvent colorables automatiquement.
Amidon: Rarement employée de nos jours, cette matrice forme un gel poreux. Les
gels d'amidon servaient à séparer les protéines destinées à des colorations
enzymatiques.
COLORATION DES PROTEINES, PHOTOGRAPHIE et ANALYSE
Il va sans dire que les protéines doivent être visibles après leur séparation. Dans la
grande majorité des cas, il faut les colorer. On peut colorer l'ensemble de protéines
séparées ou seulement un petit sous-groupe spécifique.

Les techniques de coloration varient avec le type de matrice utilisée.
On a développé des techniques rapides et efficaces de conserver des reproduction des
gels. Les techniques de numérisation permises par les progrès foudroyants de
l'informatique appliquée a permis la mise au point de elles méthodes.
RÉFÉRENCES ET BIOBLIOGRAPHIE
RF Boyer (1993) Modern experimental biochemistry (2e ed), Addison-Wesley
Publishing Company, Reading (USA). p. 114-45 [développememt assez complet des techniques
modernes d'électrophorése].
S Cook (page internet) Chromatography and electrophoresis
RMC Dawson, DC Elliot, WH Elliot, KM Jones (1986) Data for biochemical
research, Clarendon Press, Oxford p. 442-3 [tampons d'électrophorèse de protéines ou d'acides aminés sur
papier ou acétate de cellulose], 449-51 [colorants et références techniques sur l'électrophorèse de protéines et d'acides
nucléiques].
RL Dryer, GF Lata (1989) experimental biochemistry, Oxford Univesity Press,
Oxford.
P Kamoun (1977) Appareils et méthodes en biochimie, Flammarion Médecine-
Sciences, Paris.
DT Plummer (1987) An introduction to practical biochemistry (3° édition), McGraw
Hill Book Co., London.
RL Switzer, LF Garrity (1999) Experimental Biochemistry, WH Freemam, NY: 61-
77
RÉFÉRENCES SUR LE WEB
Protein electrophoresis - serum: applications cliniques de l'électrophorèse des
protéines sériques
1
/
5
100%