Progression annuelle du programme de chimie

1/6
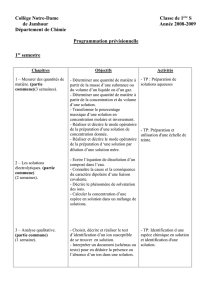
Progression annuelle du programme de chimie
Chapitre
Contenu
Objectifs
Activité ou TP
Exercices
Temps à
consacrer
1-Rappel :
Les solutions
-La mole
-Concentration molaire et
massique
-Masse volumique et
densité.
-Préparation de solutions
par dissolution et par
dilution.
1- Utiliser la mole dans le
traitement des aspects
quantitatifs.
2- Calculer les concentrations
massique et molaire d’une
espèce en solution
3- Distinguer la concentration
massique de la masse
volumique.
4-Préparer des solutions
aqueuses par dissolution d’un
soluté solide.
5- Préparer des solutions
aqueuses par dilution.
TP1 : Préparation d’une
solution mère et
dilution.
Fiche de révision :
concentration et
dilution
10 périodes
19septembre →
5octobre
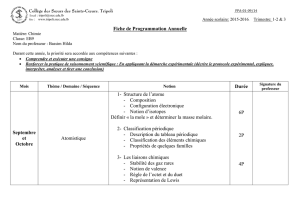
Collège de LA SAGESSE
Section Saint Jean
Brasilia - BAABDA
Département de chimie
Année scolaire : 2016-2017
Classe : S2C Bac libanais

2/6
2- Oxydation et
réduction
-Oxydation et réduction.
-Classification
électrochimique des
couples métalliques.
-Identification de quelques
ions.
1- Définir les différents
termes utilisés en
oxydoréduction.
2- Identifier un couple
oxydant/réducteur.
3-Écrire la demi-équation
électrochimique
correspondant à un couple
4-Prévoir si une réaction
d’oxydoréduction a lieu.
5-Modéliser le transfert
d’électrons dans les réactions
d’oxydoréduction.
6- Écrire une équation-bilan
d’oxydoréduction.
7-Effectuer des calculs
appropriés aux réactions
d’oxydoréduction : Identifier
le réactif limitant, le réactif en
excès.
8-Écrire une équation de
précipitation.
Activité : Action d’un
métal sur un ion
métallique, action d’un
acide sur un métal et
classification
électrochimique des
couples ox/red.
Cours au labo : tests
d’identification de
quelques ions.
Page55 n0 7-9-11-
12-16-17-18-19-20
Fiche 1 :
Classification des
couples
12 périodes
7 oct. → 31octobre
3- Le potentiel
d’oxydoréduction
- Étude d’une pile
électrochimique.
-Montage expérimental.
-Force électromotrice
d’une pile.
-Électrode standard à
hydrogène.
-Représentation
symbolique d’une pile
électrochimique.
1-Pratiquer une démarche
expérimentale pour réaliser
une pile et modéliser son
fonctionnement.
2-Relier la polarité de la pile
aux réactions mises en jeu aux
électrodes
3- Donner la représentation
symbolique d’une pile.
4-Preciser le rôle du pont
salin.
5-Définir le potentiel rédox et
le potentiel standard d’un
Cours donné au labo :
réalisation de la pile
Daniell.
TP2 : Construire des
piles galvaniques et
mesurer la d.d.p.
P.70 n0 6→10
Fiche 2 : pile
électrochimique +
stœchiométrie
12
Périodes
2nov→25novembre
1-2décembre

3/6
couple.
6-Classer les couples rédox
par rapport au couple H+/H2.
7-Prévoir si certaines
réactions rédox auront lieu.
8-Propriétés d’une pile:
capacité Q,durée de
fonctionnement t…
7 déc→ 9décembre
4- Équilibrage des
réactions rédox.
-Équilibrage des réactions
d’oxydoréduction en
milieu acide par la
méthode des deux demi-
équations
- Équilibrage des réactions
d’oxydoréduction en
milieu basique par la
méthode des deux demi-
équations
1-Équilibrer des réactions
d’oxydoréduction en milieu
acide.
2- Équilibrer des réactions
d’oxydoréduction en milieu
basique.
P.84 n0 5→11
8 périodes
13 déc→ 21déc
22-23décembre
5-Dosage
volumétrique par
réaction rédox.
Dosage volumétrique
redox : but, principe,
réaction de dosage,
caractéristiques d’une
réaction de dosage, schéma
du montage expérimental,
détermination de la
concentration inconnue.
1- Expliquer le principe du
dosage.
2-Réaliser et schématiser un
montage de dosage d’un
dosage volumétrique.
3-Décrire le mode opératoire
d’un dosage volumétrique par
réaction redox.
4-Écrire l’équation –bilan
d’une réaction de dosage et
citer ses caractéristiques.
5-Déterminer la concentration
de la solution à doser.
TP3 :
dosage d’une espèce
chimique par réaction
redox.
P.120 n0 5→9
12 Périodes
9 janvier → 13
janvier
17-18janvier
31janvier→ 3
février

4/6
Fiche3 : Exercices
supplémentaires
7-8février
6-Chimie organique :
+Analyse
élémentaire.
+ groupes fonctionnels
- Composé organique et
composé inorganique
- Analyse élémentaire
qualitative et quantitative.
-Chaîne carbonée linéaire,
ramifiée, cyclique
- Formule brute,
développée, semi-
développée.
- Isomères et types
d’isomérie.
- Quelques familles
particulières et leur groupe
fonctionnel : Alcanes,
alcènes, alcynes, alcools,
aldéhydes, cétones..
1- Identifier un composé
organique.
2-Appliquer les notions
d’analyses élémentaires
qualitative et quantitative.
3-Ecrire les formules
empirique, moléculaire et
structurale.
4- Reconnaître une chaîne
carbonée linéaire, ramifiée ou
cyclique.
5-Identifier le type
d’isomérie.
6- Distinguer quelques
familles particulières :
Alcanes, alcènes, alcynes,
alcools, aldéhydes, cétones..
7-Identifier un groupe
fonctionnel.
Activité : forme
géométrique
P.223 n0 9-11→14
14 périodes
8fév→ 10février
14fév→ 17février
21fév→ 24fév
28fév →3mars
-Les alcanes.
-Les alcènes et les
alcynes.
- Alcanes, alcènes et
alcynes
: groupe fonctionnel,
formule générale,
nomenclature, isomérie.
1-Distinguer les
hydrocarbures saturés des
hydrocarbures non saturés.
2-Identifier les alcanes et les
groupes alkyles.
P.240 n07-9-10-12-
14
P. 273 n06→11+14
12 périodes
7mars →10mars

5/6
- Réactions de combustion.
- Réactions de substitution
des alcanes.
-Réactions d’addition des
alcènes.
3- Identifier les alcènes.
4- Donner le nom
systématique d’un alcane,
d’un alcène et d’un alcyne
selon les règles de l’UICPA.
5-Écrire et nommer les
isomères d’un alcane et d’un
alcène.
6-Écrire une équation de
combustion d’un alcane, d’un
alcène et d’un alcyne.
7- Écrire l’équation d’une
réaction de substitution des
alcanes.
8- Écrire l’équation d’une
réaction d’addition des
alcènes.
14mars→ 17mars
21mars→28mars
Chapitre
supplémentaire :
Les alcools, les acides
carboxyliques et la
réaction
d’estérification
-Alcool, acide carboxylique
et ester: groupe
fonctionnel, formule
générale, nomenclature,
isomérie.
-Classes des alcools.
-Réaction d’estérification.
1-Donner le nom
systématique d’un alcool, un
acide carboxylique et un ester
2-Distinguer les classes des
alcools.
3- Réaliser une réaction
d’estérification.
4- Schématiser le montage
expérimental et préciser son
but
5-Écrire l’équation d’une
réaction d’estérification et
citer ses caractéristiques.
TP :
Estérification
Fiche4 : Exercices
supplémentaires
9 périodes
29mars→31mars
4avril →7avril
11avril→28avril
Mai : révision
 6
6
1
/
6
100%