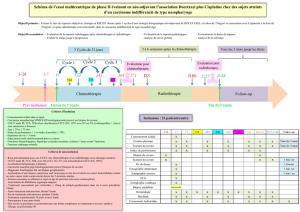
Cancer bronchique non à petites cellules


!"!""#$%&
!"#"$%&'(%)*+,-.%$/&%0!12&%0,)3%*+%&+4&54)4/(%+'14$65(7-%+
!
8(*%+9+:4-$+;<=>+
#$%&'(")("*$+,+-."/01'/"
&
"
'2"'3422456478"9:;<;4=">?::2@AB""
'%()*+%&,%&"-%./010$*%&2*$.3&'45+*#1*65%&%7&8#-+5(010$*%&9:0(#+*;.%&
8<&=>0-&'.,?&@-67*7.7&,%&8#-+5(010$*%&,%6&<064*+%6&8*)*16&,%&=>0-A&
"
)2"+8845/C7324"*:DD72="
81*-*;.%&,%&4-%./010$*%&%7&0-+010$*%&7:0(#+*;.%&
8<B&C(%-0D1%A&
"
'2"13?:C7E"#3272@""
'%()*+%&,%&"-%./010$*%&
2*1%&2E?&C(0.4%/%-7&<064*7#1*%(&F67?&@-67*7.7&,%&8#-+5(010$*%&,%6&<064*+%6&8*)*16&,%&=>0-A&
&
"
/%F-*(")("$G)+/*-%1"
&
G(#-H0*6& 2(D*D& IC(%-0D1%J?& K0/*-*;.%& 2(4*-& ILM+0-J?& 81#(*66%& 2.,*$*%(NO#1%77%& I90.10-J?& '754:#-*%& 2.,(#6N
=.+*#-*& IP0.($0*-NQ#11*%.J?& O*($*-*%& 2)(*110-& I=>0-J?& G#D(*+%& P#(156*& IL#(6%*11%J?& L#(*%77%& P#.,& I"#(*6J?& '04:*%&
P#>1%&I'7NF7*%--%J?&<#/*,&P%1:#,R&IL0.1*-6J?&2.(51*%&P%11*S(%&I81%(/0-7NG%((#-,J?&L*+:%11%&P%(70++:*&I2--%+>J?&
2--%N'04:*%&P1#-+:%7N=%$%-6& I=>0-J?&"*%((%&P0/D#(0-&I=>0-J?&T#(*/#& P0.1%,(#U&I=>0-J?&L#(*%&P(%)%7&I=>0-J?&
":*1*44%& P(.-& IO#1%-+%J?& V1*)*%(& P>1*+U*& I=>0-J?& Q#+;.%6& 8#,(#-%1& I"#(*6J?& P(.-0& 8#*11%7& I=>0-J?& Q%#-NP#47*67%&
8:#,%>(#6&I81%(/0-7NG%((#-,J?&=#(#&8:#1#D(%>66%&I=>0-J?&W%-5&8:./D*NG10(%6&I=>0-J?&8>(*11%&80-X#)(%.Y&I=>0-J?&
L#(*%&80.,.(*%(&I8:#/D5(>J?&'5D#67*%-&80.(#.,&I=>0-J?&8:#-7#1&K%+(0*6%77%&I2--%+>J?&F(*+&K%1#(0+:%&I=>0-J?&
Q%#-NL#(+&K07&I=>0-J?&":*1*44%&K.D#-,&IL0.1*-6J?&"#6+#1%&K.D(#>N=0-$%(#6&I81%(/0-7NG%((#-,J?&@6#D%11%&K./#6&
IC(%-0D1%J?&L*+:#31&K.(.*66%#.Y& IC(%-0D1%J?&=*0-%1&G#1+:%(0&IO*11%X(#-+:%N6.(N'#Z-%J?&F(*+&G#.+:0-&I'7NQ.1*%-N
%-NC%-%)0*6J?& 81#(#& G0-7#*-%NK%1#(.%11%& I=>0-J& "*%((%& G0.(-%1& I'7NF7*%--%J?& ":*1*44%& G0.(-%(%7& I8:#/D5(>J?&
O*01#*-%& G(#44#7& I8:#/D5(>J?& P5#7(*+%& C%-7*1N=%& "%+;& IP0.($0*-NQ#11*%.J?& =#.(%-+%& C5(*-*S(%& I=>0-J?& L#77%0&
C*#RN=%)(#&IC(%-0D1%J?&[*+01#6&C*(#(,&I=>0-J?&O#15(*%&C(#-$%0-&IW0#--%J?&=#.(%-7&C(%*11*%(&IL#(6%*11%J?&W%-#.,&
C(*/#& I=>0-J?& 2.(51*%& C(0.%7& I8:#10-N6.(N'#Z-%J& 8>(*1& C.*D%(7& I'7NF7*%--%J?& \#+*-%& <#/0.& I=>0-J?& '754:#-%&
<0/*-#1&I2--%+>J?&<%-(*&Q#-*+07&I81%(/0-7NG%((#-,J?&C#311%&Q%#--*-&I81%(/0-7NG%((#-,J?&=*]%&T*#U0.#/#&I=>0-J?&
=*6#& =#XX#>& I=>0-J?& '>1)*%& =#-7.%R0.1& I=>0-J?& '5D#67*%-& =#(*)5& ILM+0-J?& Q#+;.%6& =%& 9(%.7& I2*YN%-N"(0)%-+%J?&
L>(*#/& =0+#7%11*N'#-+:%]& I=>0-J?& 8#7:%(*-%& L#(*+:>& IO*%--%J?& @6#D%11%& L#(7%1N=#X#>& I=>0-J?& 851*-%& L#6+#.Y&
IL#(6%*11%J?&P5-5,*+7%&L#67(0*#--*&I=>0-J?&Q%#-NL*+:%1&L#.(>&I=>0-J?&"#7(*+U&L%(1%&I81%(/0-7NG%((#-,J?&K%-*6&
L0(0N'*D*107& IC(%-0D1%J?& @6#D%11%& L0.1%7& I=>0-J?& "*%((%& L.11%(& IO#1%-+%J?& "*%((%& L.16#-7& I=>0-J?& =.+& V,*%(&
IO*11%X(#-+:%N6.(N'#Z-%J?&Q%#-NL*+:%1&"%10-*&I=>0-J?&L#.(*+%&"5(01&I=>0-J?&L#(*%11%&"%((*+:0-&IP0.($N%-NP(%66%J?&
F/*1*%&"%((07&I=>0-J?&2--%N81#*(%&W#)%1&IP0.($0*-NQ#11*%.J?&=*-,#&'#U:(*&IC(%-0D1%J?&8:(*67*#-&'#-60-&I2--0-#>J?&
"*%((%NQ%#-& '0.;.%7& I=>0-J?& L#>%.1& 9#D.7*-& I=>0-J?& W0-#-& 9#-$.>& I=>0-J?& P(.-0& 9#)*07& I=>0-J?& W5$*6&
9%>66#-,*%(& IL0.1*-6J?& =*6%&9:*D0--*%(& I81%(/0-7NG%((#-,J?& \0#--& 9:*D0.7& IL0-74%11*%(J?& 2--%N81#*(%& 90XX#(7&
IC(%-0D1%J?& G(#-H0*6& 9(0-+& I=>0-J?& Q.1*%& O*11#& IC(%-0D1%J?& '>1)*%& O.*11%(/0]NP1#6& I=>0-J?& C:>61#*-%& ^#7+:.%-$&
IO*%--%J?&O*($*-*%&^%67%%1&IP%6#-H0-J?&O*($*-*%&_#(]#&I=>0-JA&
&
!"#$%"$&'(')*%+$',$%"*%-+.')*/+0$',12&&*3$1".''412+&'56*27$81#.'9*-$'52$+88$%1".':*%*6';$0+%.')*%+"$';$&&$+3"$.'58*+%$'-2'
<+3"*2/.' 4=1"+$' >$%%$%.' 5=?+8+*' @+A$8+".' )*%+8B&$' @+"12/.' )*#6+8-$' 912*".' <+?#1%' )*%3$8+-1".' C*#%+?D' )*&.' 928+$"' C+"&188$.'
92-+#6'C%1711&#.'E2%=8+$':F*8-2G.'58*+%$'H+&&1#.')*%#+"'<$*2-1%I'
!
! !

H"!""#$%&
!"#"$%&'(%)*+,-.%$/&%0!12&%0,)3%*+%&+4&54)4/(%+'14$65(7-%+
!
8(*%+9+:4-$+;<=>+
(I-#(1/(9")("J&+.-*(")+19".+"'$-9("(1"/K+$#(")(9"/+1/($9"
0$%1/K-J&(9"
+
!
"Les!modalités!de!prise!en!charge!du!patient!font!
l’objet! d’une! discussion! pluridisciplinaire,! tenant!
compte! de! son!âge,!du!PS,!de!ses! comorbidités,!
du! stade! TNM! et! de! la! situation! sociale.! Les!
informations! sont! transmises! dans! les! meilleurs!
délais!au!médecin!traitant.!
"Les! différents! aspects! de! la! maladie! et! des!
traitements! sont! expliqués! au! patient! et! à! sa!
famille.!
"Des! documents! d’information! sur! les! différents!
aspects!de!la!maladie!et!des!thérapeutiques!sont!
disponibles!et!remis!au!patient.!
"Les! protocoles! et! schémas! thérapeutiques! sont!
écrits,! disponibles,! connus! et! régulièrement!
actualisés.! Il! existe! des! protocoles! relatifs! à! la!
prise!en!charge!des!effets!secondaires.!
"Le! patient! doit! pouvoir! bénéficier! d’une! aide! à!
l’arrêt!du!tabagisme.!
!
"Le!patient!doit!bénéficier!d’une! prise! en! charge!
de!la!douleur.!
"Le!patient!peut! bénéficier!de!soins! palliatifs!par!
une! équipe! et/ou! une! structure! spécialisée,! fixe!
ou!mobile,!ainsi!que!de!soins!de!support.!
"Le!patient!et!sa!famille!peuvent!bénéficier!d’une!
prise!en!charge!par!un!psychologue.!!
"Le!patient!et!sa!famille!peuvent!bénéficier!d’une!
prise!en!charge!par!une!assistante!sociale.!
"Une! recherche! d’exposition! professionnelle,! en!
vue! d'une! éventuelle! déclaration! et! réparation,!
doit!être!systématique.!
"En! cas! de! constatation! de! plusieurs! cas! de!
cancers! dans! la! famille! du! patient,! une!
consultation!d’onco"génétique!sera!proposée.!
"! Le! patient! a! la! possibilité! de! participer! à! des!
protocoles! de! recherche! clinique,! à! tous! les!
stades!de!sa!pathologie!
!
+
+ +

L"!""#$%&
!"#"$%&'(%)*+,-.%$/&%0!12&%0,)3%*+%&+4&54)4/(%+'14$65(7-%+
!
8(*%+9+:4-$+;<=>+
9%FF+-$("
!
#$%&'(")("*$+,+-."/01'/"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"!!
/%F-*(")("$()+/*-%1"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"!!
(I-#(1/(9")("J&+.-*(")+19".+"'$-9("(1"/K+$#(")(9"/+1/($9"0$%1/K-J&(9"AAAAAAAAAAAAAAAAAAAAAAAAAA"H!
9%FF+-$("AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"L!
-1*$%)&/*-%1"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"M!
/.+99-N-/+*-%1"-+9./"O"&-//"!PPQ">HB"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"R!
!"#$$%&%!#'%()*+#,*$'#-.*///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*0!
0-.+1")-+#1%9*-J&("AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"SP!
0-.+1"'$(*K($+'(&*-J&("AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"SS!
1/!!233456*789:;4<*:=4>645?@25*959623@A;4*37B@9?6@59:4*B4*:9*6;34;<*C*///////////////////////////////////////////////*11!
D/!!233456*789:;4<*:=4>645?@25*E9<@769:4*C*F;4::4*4?6*:9*E:9G4*B4*:9*6H2<9G2?G2E@4*C*///////////////////////////////*11!
I/!!233456*789:;4<*:=4>645?@25*J95J:@2559@<4*@56<96H2<9G@A;4*C*/////////////////////////////////////////////////////////////*11!
K/!!233456*789:;4<*:=4>645?@25*3769?696@A;4*C*///////////////////////////////////////////////////////////////////////////////////////*1D!
L/!+:9G4*B4*39<A;4;<?*6;32<9;>*B95?*:4*M@:95*BN4>645?@25*///////////////////////////////////////////////////////////////////////*1D!
O/!"4?*B25574?*G:@5@A;4?*46*M@2:2J@A;4?*525*?E7G@P@A;4?*@5P:;45G456Q4::4?*:4*M@:95*B=4>645?@25*C*////////////////*1D!
R/!.89:;96@25*J7<@96<@A;4*//////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*1I!
0/!S@:95*E<72E7<962@<4*BN;54*GH@<;<J@4*6H2<9G@A;4*T*//////////////////////////////////////////////////////////////////////////////////*1L!
*$+-*(F(1*"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"SR!
1/!$69B4?*%*46*%%*G:@5@A;4?*UM@:95*E<7Q6H7<9E4;6@A;4VW*E96@456*2E7<9M:4*///////////////////////////////////////////////////////*1R!
1/1/!#66@6;B4*6H7<9E4;6@A;4*T*////////////////////////////////////////////////////////////////////////////////////////////////////////////////*1R!
1/D/!.>7<X?4**@5G23E:X64*T*/////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*1R!
1/I/!'<95GH4*B4*?4G6@25*4589H@4*U,1V*////////////////////////////////////////////////////////////////////////////////////////////////////*10!
1/K/!E)YQ*)1Q*)D*T*/////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*10!
1/L/!-@84<?*////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*10!
D/!$69B4?*%*46*%%*G:@5@A;4?*@52E7<9M:4?*B;*P9@6*B=;54*4>E:2<96@25*P25G6@2554::4*<4?E@<962@<4*37B@2G<4*2;*
37B@G9:43456*@52E7<9M:4*////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*1Z!
I/!&2<34?*:2G9:43456*9895G74?*U?69B4?*%%%#W*%%%SV*T*////////////////////////////////////////////////////////////////////////////////////*1Z!
I/1/!$69B4?*%%%*#*<7?7G9M:4?*GH4[*B4?*E96@456?*37B@G9:43456*2E7<9M:4?*/////////////////////////////////////////////////*1Z!
I/D/!$69B4?*%%%#*525*<7?7G9M:4W*%%%S*2;*E96@456?*525*37B@G9:43456*2E7<9M:4?*////////////////////////////////////////*1Z!
I/I/!$69B4*%%%*#*T*G9?*E9<6@G;:@4<*B4?*'K*///////////////////////////////////////////////////////////////////////////////////////////////////*DY!
I/K/!!9?*E9<6@G;:@4<*B4*6;34;<?*B4*:=9E4>*U?\5B<234*B4*+#)!(#$'*'(S%#$*]*E;<*^*2;*]*9??@3@:7*^V*/////*DY!
K/!&2<34?*3769?696@A;4?*Q*?69B4*%_*///////////////////////////////////////////////////////////////////////////////////////////////////////////*DY!
K/1/!%56<2B;G6@25*//////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*DY!
K/D/!"4?*E<262G2:4?*B4*GH@3@26H7<9E@4*B4*E<43@X<4*:@J54*U45*:N9M?45G4*B4*3;696@25*9G6@896<@G4**.`&,V*/*D1!
K/I/!-;<74*2E6@39:4*B4*:9*GH@3@26H7<9E@4*B4*E<43@X<4*:@J54*B95?*:4?*?69B4?*%_*C*//////////////////////////////////*DD!
K/K/!!H@3@26H7<9E@4*B4*39@564595G4*////////////////////////////////////////////////////////////////////////////////////////////////////*DI!
K/L/!'<9@643456*B4*?4G25B4*46*6<2@?@X34*:@J54*//////////////////////////////////////////////////////////////////////////////////////*DI!
K/L/1/!!9<G@5234*7E@B4<32aB4*/////////////////////////////////////////////////////////////////////////////////////////////////////////////////*DI!
K/L/D/!!95G4<?*525Q7E@B4<32aB4?*/////////////////////////////////////////////////////////////////////////////////////////////////////////////*DI!
K/O/!'<9@643456*B4*:@J54*;:67<@4;<4*///////////////////////////////////////////////////////////////////////////////////////////////////////*DK!
K/R/!F;4?6@25?*B@84<?4?*/////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*DK!
L/!';34;<*984G*3;696@25*9G6@896<@G4*B4*:N.`&,*/////////////////////////////////////////////////////////////////////////////////////////*DL!
L/1/!#;*B@9J52?6@G*@5@6@9:*///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*DL!
L/D/!,7Q782:;6@25*6;32<9:4*///////////////////////////////////////////////////////////////////////////////////////////////////////////////////*DL!
L/I/!+<2J<4??@25*?2;?*6<9@643456**E9<*'b%*956@*.`&,*/////////////////////////////////////////////////////////////////////////////*DL!
O/!';34;<*984G*<7Q9<<95J43456*B4*#"b*////////////////////////////////////////////////////////////////////////////////////////////////////*DO!
O/1/!c5*6<9@643456*E9<*!<@[26@5@M*4?6*@5B@A;7*d*E9<6@<*B4*:9*1X<4*:@J54*/////////////////////////////////////////////////////*DO!
O/D/!+<2J<4??@25*?2;?*6<9@643456*?2;?*!<@[26@5@M*///////////////////////////////////////////////////////////////////////////////////*DO!
O/I/!+<2J<4??@25*?2;?*!4<@6@5@M*//////////////////////////////////////////////////////////////////////////////////////////////////////////////*DO!
R/!,7Q9<<95J43456?*B4*,($1*////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*DO!
)-,($9"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"!M!
1!!95G4<?*3769GH<254?*2;*?\5GH<254?*////////////////////////////////////////////////////////////////////////////////////////////////////*DO!
D!!95G4<*M<25GH@A;4*?;<*E2;325*;5@A;4*/////////////////////////////////////////////////////////////////////////////////////////////////*DO!

T"!""#$%&
!"#"$%&'(%)*+,-.%$/&%0!12&%0,)3%*+%&+4&54)4/(%+'14$65(7-%+
!
8(*%+9+:4-$+;<=>+
/+1/($"$+)-%5%//&.*("AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"!M!
/%1)&-*("+"*(1-$")(,+1*"&1"1%)&.("'&.F%1+-$("'($-'K($-J&("AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"!R!
)('-9*+#("AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"!U!
9%-19")("9&''%$*"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"!Q!
9&$,(-..+1/("AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"!Q!
+$0$(9")(/-9-%11(.9"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"HP!
1/!$69B4?*%*46*%%*//////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*I1!
D/!$69B4?*G%%%#*///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*ID!
I/!$69B4?*%%%S*////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*II!
K/!';34;<?*B4*:N9E4>*////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*IK!
L/!$69B4*%_*e*!9<G@5234*7E@B4<32aB4*///////////////////////////////////////////////////////////////////////////////////////////////////////*IL!
O/!$69B4*%_*e*)()*7E@B4<32aB4*e*1X<4*:@J54*46*39@564595G4*//////////////////////////////////////////////////////////////////////*IO!
R/!$69B4*%_*e*)()*7E@B4<32aB4*e*$4G25B4*:@J54*////////////////////////////////////////////////////////////////////////////////////////*IR!
0/!f;696@25*.`&,*/////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*I0!
Z/!,79<<95J43456*#"b*/////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////*IZ!
+11(I("S"V"U(F("/.+99-N-/+*-%1"*1F"">-+9./"!PSTW"&-//"!PSRB">QB"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"LP!
+11(I("!"V"/.+99-N-/+*-%1"+1+*%F%5'+*K%.%#-("!PST">!UW!QB"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"L!!
$(N($(1/(9"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"LM!
)(/.+$+*-%1")(9".-(19")X-1*($(*9"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"LU!
F(1*-%19".(#+.(9"AAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA"LU!
&
! !
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%