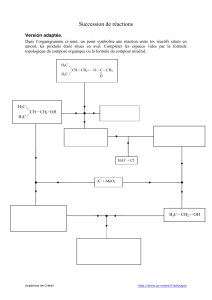
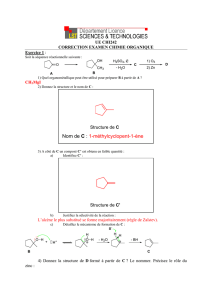
I. Les modifications visées par le chimiste

27/05/2017 582824891 1/2
Thème : Comprendre – Lois et modèles
Cours
Chimie
Transformations en chimie organique
Chap.13
I. Les modifications visées par le chimiste
Le chimiste part d’espèces chimiques simples ou disponibles dans le commerce. Il choisit la nature et l’ordre des
transformations en fonction du coût et de la sécurité.
1. Modification de groupe
Transformation permettant d’ajouter, d’enlever ou de remplacer un groupe caractéristique d’une entité
chimique, sans modification de sa chaîne carbonée
Exemple :
2. Modification de chaîne
Transformation permettant de modifier la chaîne carbonée d’une entité chimique.
Exemple :
II. Des catégories de réaction
1. Substitution
Au cours d’une réaction de substitution, un atome ou un groupe d’atomes de la molécule étudiée est
remplacé par un autre atome ou groupe d’atomes.
Exemple :
2. Addition
Au cours d’une réaction d’addition, des atomes ou groupe d’atomes se lient à la molécule étudiée sans que
celle-ci ne perde d’atomes.
Exemple :
CH3
CH CH2
CH3
OH
CH3
C
CH2
CH3
O
KMnO4
CH3
CH2CH2
COCH3
O
1) LDA
2) CH3CH2ICH3
CH2CH CO
O
CH3
CH2CH3
C C
O
O
H
H
H
H+C OH
H
H
H
C C
O
O C
H
H
H
H
H
H+OHH
C
CH3
CH2
CH3+OHH CH3C
CH3
C
OH H
H
H

27/05/2017 582824891 2/2
3. Elimination
Au cours d’une réaction d’élimination, des atomes ou groupe d’atomes sont ôtés de la molécule étudiée
sans que celle-ci ne gagne d’atomes.
Exemple :
III. Les mécanismes réactionnels
1. Aspect microscopiques
La formation d’une liaison peut être expliquée par l’attraction électrostatique entre un site donneur de
doublet d’électrons et un site accepteur de doublet d’électrons.
Un site donneur de doublet d’électrons est :
Atome présentant un excès d’électrons, c'est-à-dire une charge partielle négative - ou une charge négative -.
Une liaison multiple
Un atome portant un doublet non liant
Un site accepteur de doublet d’électrons est un atome présentant un défaut d’électrons, c'est-à-dire une charge
partielle positive + ou une charge positive +.
La polarité d’une liaison se déduit des électronégativités des atomes impliqués.
Les liaisons C-H sont non polarisées.
Les liaisons +C - O- et +H - O- sont polarisées par exemple.
2. Les étapes d’un mécanisme réactionnel
Un mécanisme réactionnel modélise le déroulement d’une réaction chimique à l’échelle moléculaire. Il
décrit les étapes successives de rupture et de formation de liaisons au sein de molécules.
En une seule étape : formation et rupture de la liaison sont simultanées
Exemple : CH3 – Cl + I- CH3 – I + Cl-
Un mouvement de doublets d’électrons permet d’expliquer la formation ou la rupture de la liaison. Il faut
repérer le site donneur de doublet d’électrons et le site accepteur de doublet d’électrons. Une flèche courbe
représente le mouvement du doublet d’électrons
En plusieurs étapes : synthèse du propan-2-ol
C
CH3
CH3O
HH
+2 MnO4- + 6 H3O+2 Mn2+ + 14 H2O
CH3CCH3
O
+
55
I-+CH3Cl CH3
I+Cl-
CH3
CH CH2+OH2CH3
CH CH3
OH
H+
CH3
CH CH2H+
CH3
CH+
CH2
H
CH3
CH+
CH2
H+H
O
H
CH3
CH
CH3
O+
H
H
CH3
CH
CH3
O+
H
H
CH3
CH
CH3
OH
+H+
1
/
2
100%