30871_quantification..

Les deux premiers documents visent à montrer comment au début du XXème siècle, les physiciens
ont remis en questions les lois de la mécanique dite Newtonienne.
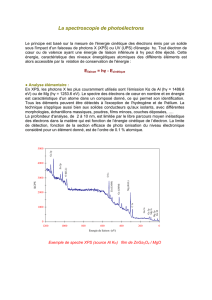
Document 1 : L’expérience de Franck et Hertz.
En 1914, James Franck et Gustav Hertz publient les résultats d'une expérience mettant en
évidence un phénomène inexplicable dans !e cadre de la mécanique Newtonienne : la quantification
des échanges d'énergie entre un faisceau d'électrons et un gaz d'atomes. Ces travaux leur valent le
prix Nobel de physique une dizaine d'années plus tard.
L'expérience consiste à bombarder un gaz d'atomes à faible pression (Franck et Hertz utilisèrent
une vapeur de mercure), à l'aide d'un faisceau d'électrons homocinétiques, c'est-à-dire ayant tous
la même vitesse et donc la même énergie cinétique.
Dans son principe, l'expérience est constituée ( doc. 1)
- d'un canon à électrons, appareil capable d'émettre des électrons d'énergie cinétique donnée ;
- d'un analyseur, c'est-à-dire d'un appareil permettant de recueillir et de compter le nombre
d'électrons ayant une énergie cinétique donnée. Les électrons dont l'énergie cinétique est
différente de l'énergie spécifiée ne sont pas comptabilisés ;
- d'une enceinte enfermant une vapeur de mercure à faible pression, le canon et l'analyseur.
On règle le canon à électrons et l'analyseur sur la même valeur de l'énergie cinétique. À l'aide du
canon à électrons, on bombarde alors le gaz de mercure et on recueille les électrons dans
l'analyseur. On effectue l'expérience en faisant varier l'énergie cinétique des électrons issus du
canon. L'analyseur est au fur et à mesure calibré sur leur énergie cinétique.
Résultats de l'expérience :
- On constate, dans un premier temps, que tant que l'énergie cinétique des électrons incidents
est inférieure à 4,9 eV, le nombre d'électrons Nc comptabilisés par l'analyseur est égal au
nombre d'électrons Ne émis par le canon : (Nc/Ne = 1)
- Pour une énergie incidente de 4,9 eV, on note une chute brutale du rapport Nc/Ne.
- Lorsque l'énergie augmente de nouveau, le rapport Nc/Ne varie très peu.
Interprétation des résultats :
En traversant le gaz, les électrons émis par le canon peuvent entrer en collision avec les atomes de
mercure. Si leur énergie cinétique est inférieure à 4,9 eV, les électrons ne cèdent pas d'énergie aux
atomes lors des chocs. En revanche, si un électron possède une énergie cinétique de 4,9 eV et qu'il
entre en collision avec un atome de mercure, il cède toute cette énergie à l'atome. Ces électrons ne
sont plus comptabilisés par l'analyseur, ce qui explique la chute brutale du rapport Nc/Ne.
Un électron d'énergie cinétique E, supérieure à 4,9 eV cédera 4,9 eV à l'atome avec lequel il entre
en collision. N'ayant plus que l'énergie cinétique Ec - 4,9 eV, cet électron ne sera pas pris en compte
par l'analyseur réglé sur Ec.
Les échanges d'énergie entre les électrons et les atomes du gaz lors des collisions sont donc
quantifiés: seules certaines quantités d'énergie bien précises peuvent être échangées.
Activité documentaire :
L’atome, un monde quantique.

Questions :
1) Comment expliquer que le rapport Nc/Ne reste constant ( = 1) dans un premier temps ? En
serait-il de même si les électrons étaient des boules, et les atomes des quilles ?
2) Comment expliquer la chute brutale du rapport du rapport Nc/Ne aux alentours de 4,9 eV ?
3) Où est passé l’énergie perdue par les électrons ?
4) Les électrons peuvent-ils céder n’importe quelle quantité d’énergie aux atomes du gaz ?
5) Le principe de conservation de l’énergie pose que l’énergie échangée par un système est égale
à la variation de sa propre énergie. Que peut-on en déduire quant-à l’énergie des atomes ?
6) Ceci peut-il être expliqué par la mécanique Newtonienne ?
Document 2 : Compréhension du spectre de raies de l’hydrogène.
Le spectre de la lumière visible émise par le Soleil ou par une lampe à incandescence est continu :
toutes les radiations monochromatiques y sont présentes. En revanche, si l'on étudie la lumière
émise par une lampe à décharge, on obtient un spectre d'émission constitué de raies. La longueur
d'onde dans le vide de ces raies est caractéristique de la structure atomique de l'entité chimique
contenue dans le tube. On se propose d'étudier ici le spectre de raies de l'atome d'hydrogène.
Une décharge électrique dans une lampe «à vide» contenant un élément gazeux monoatomique ou
diatomique, à faible pression, produit un rayonnement dont on peut observer le spectre avec un
spectroscope.
Dans le domaine optique, c'est-à-dire pour les longueurs d'onde comprises entre 400 nm et 800 nm,
le spectre est constitué de quelques raies colorées, correspondant chacune à une radiation
monochromatique de longueur d'onde bien précise. On dit que le spectre est discret.
Si on analyse le spectre optique de l'hydrogène, on constate la présence de quatre raies bien
distinctes, dont les longueurs d'onde dans le vide ont pour valeur : = 411 nm, = 435 nm, = 487
nm et = 657 nm.
Dans les années 1880, J. J. Balmer et J. R. Rydberg puis W. Ritz analysent ces valeurs et proposent
une relation s'accordant parfaitement avec les résultats expérimentaux. Grâce à leur formule, les
longueurs d'onde des raies du domaine visible sont en effet repérées par deux nombres entiers p et
, avec n = 1, 2, 3, etc. et p > n. Elle s'écrit :
²
1
²
11 pn
RH
np
A partir d'une valeur de n donnée, on peut donc calculer toute une série de raies en faisant varier
l'entier p. Ainsi, la série dite de Balmer correspond à n = 2 et donne les longueurs d'onde des quatre
raies visibles, obtenues à partir de n=2 et p = 3, 4, 5 et 6.
La validité de cette expression est vérifiée expérimentalement dans le domaine infrarouge en 1908
par F. Paschen, qui mesure les longueurs d'onde des radiations émises dans ce domaine. Elles
coïncident avec la formule précédente pour n = 3 et p > 3. Cette nouvelle série correspondant à n = 3
porte le nom de série de Paschen. En 1916, T. Lyman mesure une série de raies dans le domaine
ultraviolet. Les valeurs des longueurs d'onde mesurées s'accordent avec l'expression précédente
pour n = 1 et p > 1 (série de Lyman).

En 1913, le physicien danois Niels Bohr propose une théorie qui permet d'interpréter le spectre de
raies de l'hydrogène. En se fondant sur certaines hypothèses novatrices, il calcule que l'énergie
d'un atome d'hydrogène est donnée par la relation
²6,13
n
En
(en eV) où n est un entier positif.
L'énergie de l'atome d'hydrogène est donc quantifiée, ne prenant que certaines valeurs
particulières, indexées par le nombre entier n, appelé nombre quantique.
Questions :
1. Calculer les différentes valeurs de l’énergie d’un atome d’hydrogène.
2. Exprimer la différence entre 2 niveaux d’énergie, p en : En – Ep.
Devant la troublante similitude avec les travaux de Ritz, M. Planck propose qu’un atome d’hydrogène
puisse changer de niveau d’énergie par interaction avec la lumière soit en captant un photon
(augmentation du niveau d’énergie) soit en émettant un photon (baisse du niveau d’énergie). Le
photon émis ou absorbé ayant une énergie E = h.ν où ν est la fréquence du photon et h la constante
de Planck égale à 6,62 × 10-34 J.s
3. Montrer que ces relations sont compatibles avec les travaux de Ritz.
4. Déterminer les raies d’émission du spectre de l’hydrogène pour les séries de Lyman, Balmer
et Paschen.
1
/
3
100%