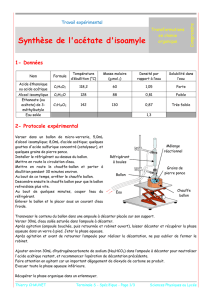
devoir vacances de paques ex 3 correction

On réalise un chauffage à reflux avec 20mL de propanol, 35 mL d’acide butanoïque et quelques gouttes d’acide
sulfurique. Il se forme du butanoate de propyle et de l’eau, la réaction est limitée.
Après 20 minutes, on éteint le chauffage et on laisse refroidir le milieu réactionnel, on le transvase dans une ampoule
à décanter, puis on rajoute de l’eau froide salée. On agite l’ampoule à décanter et on laisse reposer, il se forme 2
phases : une phase aqueuse et une phase organique.
1. Comment nomme le montage ci-contre ? Compléter la légende .
2. Pourquoi chauffe-t-on ?
3. Quel est l’intérêt de l’acide sulfurique?
Exercice 3 :
Données:
Propanol : M=60g/mol peu soluble dans l’eau Teb=97°C d=0,803 n=1,381
Acide butanoïque : M=88 g/mol assez soluble dans l’eau Teb= 118°C d=0,961 n=1,402
Butanoate de propyle : M=130 g/mol pas soluble dans l’eau Teb=143°C d=0,87 n=1,390
L’alcool et l’acide carboxylique sont solubles dans l’ester.
L’acide sulfurique est très soluble dans l’eau.
Les ions butanoate H3C-CH3-CH3-COO-sont très solubles dans l’eau.
4. Écrire l’équation-bilan de la réaction (ne pas tenir compte de l’acide sulfurique) . La
réaction est limitée.
5. Dessiner l’ampoule à décanter avec les 2 phases, préciser le contenu de chacune
d’elles.
6. Donnée : couple acide/base CO2/HCO3-
On garde la phase organique, on ajoute une solution d’hydrogénocarbonate de sodium
(Na++HCO3-). Les 2 solutions sont placées dans l’ampoule à décanter, on agite
l’ampoule. La base HCO3-, introduite en excès, engendre une réaction totale. On
dégaze pour supprimer la surpression puis on laisse décanter.
Quel est l’intérêt de cette étape? Expliquer.
7. On sépare à nouveau la phase aqueuse de le phase organique.
Dans la phase organique, comment isoler l’ester des autres espèces ?
8. Comment vérifier la pureté de l’ester obtenu ?
9. Déterminer les quantités de réactifs introduits - propanol et acide butanoïque - au
début de la synthèse.
10. Après les étapes de séparation et purification, on obtient 0,12 mol d’ester.
Déterminer le rendement de la réaction, on pourra s’aider d’un tableau d’avancement.
11. Quel volume d’ester obtient-on finalement ?
1
2
3
4
1
/
1
100%