Lamines A/C et anomalies métaboliques - Lamins A/C

Lamines A/C et anomalies métaboliques
Lamins A/C and metabolic disorders
A. Decaudain*, B. Donadille*, O. Lascols*,**, V. Béréziat*, J. Capeau*,***, C. Vigouroux*,***
L
es laminopathies, maladies liées à des mutations
dans le gène LMNA, codant les lamines A et C, font
depuis une dizaine d’années l’objet d’une attention
particulière de la part de la communauté scientifique. En
effet, de façon fascinante et rare en génétique humaine,
les mutations du gène LMNA sont responsables de plu-
sieurs pathologies très différentes. L’attention des endo-
crinologues est tout particulièrement attirée par le fait
que l’une de ces maladies, la lipodystrophie partielle
familiale de Dunnigan, est responsable d’un syndrome
d’insulinorésistance sévère. Cette découverte a plusieurs
conséquences. D’une part, l’étude de la physiopatholo-
gie de cette lipodystrophie est particulièrement intéres-
sante pour mieux comprendre l’implication des lamines
dans la répartition du tissu adipeux et ses conséquences
métaboliques ; ces travaux sont également importants
pour comprendre le syndrome métabolique commun,
dont la lipodystrophie de Dunnigan représente une forme
clinique caricaturale. D’autre part, les progrès récents
dans l’analyse génotype-phénotype des laminopathies
permettent de mettre l’accent sur la variabilité des pré-
sentations cliniques de ces lipodystrophies. Étant parfois
atypiques, parfois associés aux signes musculaires,
cardiaques ou de vieillissement accéléré des autres
laminopathies, les syndromes d’insulinorésistance liés
aux mutations des lamines A/C sont probablement sous-
diagnostiqués.
* INSERM U680, faculté de médecine Pierre-et-Marie-Curie, site Saint-Antoine,
Paris.
** Laboratoire de biologie moléculaire, Fédération de biochimie, hôpital
Saint-Antoine, Paris.
*** Service de biochimie et hormonologie, hôpital Tenon, Paris.
74
Métabolismes Hormones Diabètes et Nutrition (X), n° 2, mars/avril 2006
Mise au point
Mise au point
▲
▲ Les lamines A/C, issues du gène LMNA, présentes
dans le noyau de toutes les cellules différenciées,
possèdent un double rôle, structural et fonctionnel.
▲
▲ Les mutations du gène LMNA sont responsables de
différentes “laminopathies”, schématiquement regrou-
pées en trois groupes de pathologies : les dystro-
phies neuromusculaires, la lipodystrophie partielle
familiale de Dunnigan (et ses formes apparentées)
et les syndromes de vieillissement accéléré.
▲
▲ La physiopathologie des laminopathies est complexe
et encore mal connue, mais l’analyse de nombreux
phénotypes mixtes (ou chevauchants) suggère l’exis-
tence d’un continuum pathologique.
▲
▲ La lipodystrophie partielle familiale de Dunnigan
associe cliniquement une lipoatrophie sous-cutanée
postpubertaire des membres et du tronc (épargnant
la région cervicofaciale), une hypertrophie musculaire
et un hirsutisme (inconstant) chez la femme.
▲
▲ Les troubles métaboliques sont caractérisés par une
insulinorésistance souvent majeure, se compliquant
fréquemment de diabète, et par une dyslipidémie
prédominant sur les triglycérides, auxquelles s’asso-
cient souvent une stéatose hépatique et un syndrome
des ovaires polykystiques chez la femme.
▲
▲ La lipodystrophie partielle familiale de Dunnigan
expose à un risque immédiat de pancréatite aiguë
secondaire aux poussées d’hypertriglycéridémie
ainsi qu’à un risque accru de complications cardio-
vasculaires précoces.
▲
▲ Il existe des formes atténuées de lipodystrophie de
Dunnigan, parfois très proches du syndrome méta-
bolique banal, de dépistage difficile.
▲
▲ Des signes de dystrophie musculaire, de cardio-
myopathie et/ou de vieillissement accéléré peuvent
être observés dans les lipodystrophies liées aux
mutations des lamines A/C.
▲
▲ C’est donc un faisceau d’arguments cliniques et
paracliniques qui fera évoquer le diagnostic de lami-
nopathie et motivera la réalisation d’une enquête
génétique, la notion de cas similaires dans la famille
avec une transmission dominante potentielle étant
essentielle.
▲
▲ Le dépistage des complications éventuelles et des
atteintes associées, particulièrement des troubles
du rythme et de la conduction cardiaques, est indis-
pensable chez tout patient porteur d’une mutation
LMNA, ainsi que le dépistage des apparentés, per-
mettant une prise en charge précoce.
points FORTS

Les lamines A/C
Les lamines A et C, produites par épissage alternatif du
gène LMNA (situé sur le chromosome 1q), sont les princi-
pales isoformes des lamines de type A, protéines ubiqui-
taires exprimées dans le noyau de presque toutes les cel-
lules différenciées. Ces protéines de la famille des filaments
intermédiaires sont composées d’un domaine central de
dimérisation hélicoïdal flanqué de domaines globulaires N
et C-terminaux. Les lamines A/C s’homo- et s’hétéropoly-
mérisent avec les lamines de type B, issues d’un gène dis-
tinct, pour former la lamina, réseau filamentaire qui tapisse
la face interne de l’enveloppe nucléaire. De par leur posi-
tion périphérique dans le noyau, les lamines ont été propo-
sées très tôt comme support mécanique de l’enveloppe
nucléaire et point d’ancrage pour l’hétérochromatine. Mais
les lamines A/C ne possèdent pas seulement ce rôle struc-
tural au sein du noyau. En effet, elles interagissent avec de
nombreux composants nucléaires (protéines de la mem-
brane interne du noyau, pores nucléaires permettant les
transferts de molécules entre le cytoplasme et le noyau, fac-
teurs transcriptionnels régulant l’expression des gènes,
ADN et ses protéines associées telles que les histones, etc.)
jouant ainsi un autre rôle, encore incomplètement élucidé,
dans de nombreuses fonctions cellulaires.
Les laminopathies (tableau)
La responsabilité des mutations du gène LMNA en patho-
logie a d’abord été mise en cause en 1999 dans la dystro-
phie musculaire d’Emery-Dreifuss (Emery-Dreifuss mus-
cular distrophy [EDMD]) (1). Cette pathologie, transmise
le plus souvent sur un mode autosomique dominant, est
caractérisée par une atrophie et un déficit musculaires
d’apparition progressive dans l’enfance, débutant aux par-
75
Métabolismes Hormones Diabètes et Nutrition (X), n° 2, mars/avril 2006
Mise au point
Mise au point
Syndromes Principales caractéristiques cliniques et biologiques Mutations du gène LMNA en cause
Dystrophie musculaire – contractures (chevilles, coudes, nuque)
d’Emery-Dreifuss, autosomale – déficit musculaire et amyotrophie des membres
dominante ou récessive (EDMD) – troubles de la conduction cardiaque constants à l’âge adulte
Dystrophie musculaire – déficit musculaire prédominant aux ceintures
des ceintures, autosomale – contractures absentes ou tardives
dominante (LGMD, type 1B) – troubles de la conduction cardiaque fréquents à l’âge adulte
Cardiomyopathie dilatée avec – troubles de la conduction et/ou du rythme cardiaques
troubles conductifs, autosomale – cardiomyopathie dilatée
dominante (DCM-CD) – insuffisance cardiaque
Neuropathie axonale de – déficit musculaire et amyotrophie distales avec aréflexie R298C homozygote
Charcot-Marie-Tooth, autosomale – vitesse de conduction nerveuse normale ou peu diminuée (domaine central)
récessive (CMT, type 2B1) – dégénérescence axonale
Lipodystrophie partielle familiale – lipodystrophie partielle d’apparition postpubertaire avec lipoatrophie Principalement mutations
de Dunnigan, autosomale des membres et du tronc et accumulation facio-tronculaire des graisses hétérozygotes faux-sens
dominante (FPLD) – insulinorésistance, hypertriglycéridémie, stéatose hépatique au codon 482 (domaine C-terminal)
Dysplasie acromandibulaire, – retard de croissance postnatal, hypoplasie mandibulaire et R527H ou A529V homozygote
autosomale récessive (MAD) claviculaire, ostéolyse distale, retard de fermeture des fontanelles, (domaine C-terminal)
limitations articulaires Un cas décrit avec mutation
– papules cutanées hypo- et hyperpigmentées hétérozygote composite
– lipodystrophie, insulinorésistance, hypertriglycéridémie de la protéase de maturation
de la prélamine A, ZMPSTE24
Progéria de Hutchinson-Gilford, – retard de croissance postnatal, micrognatie, ostéodysplasie Principalement G608G (GG C> GGT)
autosomale dominante généralisée hétérozygote conduisant
[apparition de novo] (HGPS) – alopécie, aspect sclérodermiforme de la peau à une prélamine A tronquée
– lipoatrophie généralisée, athérosclérose précoce responsable et mal maturée
de la mortalité avant l’âge adulte
Dermopathie restrictive, – retard de croissance intra-utérin, gangue cutanée érosive Mutation hétérozygote G608G ou
autosomale dominante hyperkératosique, micrognatie, défaut de minéralisation osseuse, du site donneur d ‘épissage de
ou récessive hypoplasie claviculaire l’intron 11 (IVS11 + 1G >A) conduisant
– hypoplasie pulmonaire à une prélamine A tronquée
– contractures articulaires et mal maturée ;
– mortalité néonatale (première semaine de vie) ou
mutation des deux allèles
de ZMPSTE24
Tableau. Les laminopathies.
Nombreuses mutations différentes
réparties tout au long du gène,
majoritairement hétérozygotes
de type faux-sens

ties proximales des membres, associés à des contractures
musculaires et tendineuses précoces, puis à des troubles
conductifs cardiaques chez l’adulte. Des mutations hété-
rozygotes du gène LMNA ont ensuite été découvertes dans
deux autres maladies : une forme de cardiomyopathie
dilatée (dilated cardiomyopathy and conduction-system
disease [DCM-CD]) et une forme de dystrophie muscu-
laire des ceintures (limb-girdle muscular dystrophy, type
1B [LGMD]). Ces trois pathologies, EDMD, DCM-CD
et LGMD, ont en commun des troubles conductifs car-
diaques de sévérité variable, exposant parfois au risque de
mort subite et pouvant nécessiter la pose d’un pacemaker
ou d’un défibrillateur implantable. Ces phénotypes mus-
culaires et/ou cardiaques peuvent être de sévérité très
variable, allant de formes asymptomatiques à des formes
gravissimes de dystrophies musculaires congénitales. Les
mutations, très diverses, peuvent affecter chacun des
domaines protéiques des lamines A/C.
Le même gène LMNA a ensuite été impliqué dans la lipo-
dystrophie partielle familiale de Dunnigan (FPLD, appelée
aussi FPLD de type 2), de transmission autosomique domi-
nante (2). Les mutations, le plus souvent faux-sens, affec-
tent dans plus de trois quarts des cas le codon 482 dans
l’exon 8 du gène, qui code pour la partie globulaire C-ter-
minale de la protéine, impliquée dans la liaison à l’ADN et
à certains facteurs de transcription dont SREBP-1, qui
intervient dans la différenciation adipocytaire. Survenant
de manière encore inexpliquée à la puberté, la FPLD est
caractérisée par une disparition du tissu adipeux sous-
cutané au niveau du tronc et des membres, associée à une
accumulation de tissu adipeux dans
la région intra-abdominale périvis-
cérale et cervicofaciale (donnant
parfois un aspect pseudo-cushin-
goïde au patient), et à une hyper-
trophie musculaire, en particulier
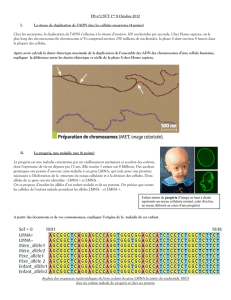
des mollets (figure). Les anoma-
lies biologiques sont marquées par
une insulinorésistance souvent
sévère, pouvant se traduire clini-
quement par un acanthosis nigri-
cans, c’est-à-dire par un aspect de
peau épaissie et brunâtre aux plis
de flexion, en particulier axillaires.
L’insulinorésistance se complique
progressivement de troubles de la
tolérance au glucose puis de dia-
bète, souvent difficile à contrôler.
La dyslipidémie est fréquente et
précoce, associant une hypertrigly-
céridémie souvent majeure et une
baisse du HDL-cholestérol. Enfin,
sont fréquemment retrouvés une
stéatose hépatique, une hyperten-
sion artérielle et un syndrome des
ovaires polykystiques avec hyper-
androgénie chez la femme. La sévérité des troubles semble
être dépendante du sexe, les femmes présentant une lipo-
dystrophie et des anomalies métaboliques plus sévères (3).
Les complications dégénératives du diabète, la pancréatite
aiguë secondaire aux poussées d’hypertriglycéridémie, la
cirrhose hépatique et les complications cardiovasculaires
(secondaires à une athérosclérose précoce) sont les princi-
pales causes de morbimortalité dans la FPLD (4).
Une forme de neuropathie axonale (Charcot-Marie-Tooth
disorder, type 2 [CMT2]) a été ensuite montrée comme
associée à la mutation homozygote R298C du gène
LMNA, dans le domaine central de dimérisation (5). Cette
maladie s’exprime dès l’enfance, associant fatigabilité
musculaire bilatérale et symétrique, atrophie musculaire
distale des quatre membres, aréflexie et raréfaction des
fibres axonales myélinisées périphériques en histologie.
De façon inattendue, le gène LMNA a été impliqué en
2002 dans deux syndromes de vieillissement accéléré : la
dysplasie acromandibulaire et la progéria, syndrome de
Hutchinson-Gilford. Cette dernière, extrêmement rare
(moins d’un cas pour un million de naissances), se déve-
loppe progressivement après la naissance, dès l’âge de
6 mois, et associe retard de croissance, lipoatrophie géné-
ralisée, faciès typique (avec micrognathie, exophtalmie et
nez crochu [bird-like facies], atteinte sclérodermiforme de
la peau, ostéolyse claviculaire et phalangienne, et signes
évoquant un vieillissement précoce (alopécie, ostéoporose,
atteinte dégénérative des cartilages, athérosclérose, calci-
fications artérielles, etc.). Le décès est précoce, en
moyenne vers l’âge de 14 ans, du fait de l’atteinte cardio-
vasculaire. La mutation la plus fréquemment retrouvée est
hétérozygote ; elle apparaît de novo et concerne spécifi-
quement la région C-terminale de la seule isoforme A de
la lamine. Par activation d’un site cryptique d’épissage,
cette mutation entraîne la production d’une forme tronquée
de la lamine A, appelée “progérine”, incapable de subir la
maturation protéolytique normale de la protéine (6, 7). Des
signes cliniques très similaires, mais moins sévères et plus
tardifs, caractérisent la dysplasie acromandibulaire, dans
laquelle on retrouve aussi une lipodystrophie partielle, une
insulinorésistance, une hypertriglycéridémie et une baisse
du HDL-cholestérol. Ce syndrome est dû soit à des muta-
tions LMNA homozygotes touchant, comme dans la lipo-
dystrophie de Dunnigan, le domaine globulaire C-termi-
nal des lamines A et C, soit à une mutation inactivatrice
homozygote du gène codant l’enzyme ZMPSTE24, métal-
loprotéase impliquée dans la maturation post-traduction-
nelle de la prélamine A en lamine A. Enfin, la dermopathie
restrictive est la laminopathie à la fois la plus grave et la
plus récemment individualisée. Cette pathologie extrême-
ment rare s’exprime par un retard de croissance intra-uté-
rin sévère et une dysplasie majeure de la peau, rigide et
tendue, réalisant une véritable gangue restrictive. Une
hypoplasie pulmonaire entraîne le décès au cours de la
première semaine de vie, chez des enfants qui présentent
aussi les signes osseux caractéristiques de la progéria. Les
76
Métabolismes Hormones Diabètes et Nutrition (X), n° 2, mars/avril 2006
Mise au point
Mise au point
Figure. Patiente atteinte
de lipodystrophie
de Dunnigan.

anomalies génétiques en cause sont soit une mutation hété-
rozygote du gène LMNA de novo conduisant à l’expression
d’une prélamine A tronquée, soit des mutations homozy-
gotes ou hétérozygotes composites concernant le gène de
l’enzyme ZMPSTE24 (8).
Des signes de laminopathies musculaires
et/ou cardiaques, ainsi que des signes
de vieillissement accéléré, peuvent être
observés dans les lipodystrophies
liées aux lamines A/C
La position des mutations sur le gène LMNA est un élé-
ment qui détermine indiscutablement le phénotype des
diverses laminopathies. Cependant, des associations de
phénotypes (phénotypes croisés ou chevauchants) ont été
décrites. Ainsi, des lipodystrophies partielles associées à
des dystrophies musculaires et/ou à des cardiomyopathies
dilatées avec troubles de la conduction ont été décrites, les
mutations en cause touchant le domaine central ou C-ter-
minal de la lamine A/C (9). Un patient de 30 ans, exploré
pour une lipoatrophie généralisée avec diabète insulino-
résistant, hypertriglycéridémie et stéatose hépatique
sévère, présentait aussi une atteinte cutanée et certains
signes de vieillissement accéléré (sans que les critères
diagnostiques de la progéria ou de la dysplasie acroman-
dibulaire soient réunis) liés à une mutation hétérozygote
R133L apparue de novo (10). Enfin, la lipoatrophie, géné-
ralisée ou partielle, fait partie du tableau clinique habituel
de la progéria et de la dysplasie acromandibulaire.
La forme typique du syndrome de Dunnigan, décrite plus
haut, est liée à une mutation LMNA faux-sens au
codon 482, considérée comme pathognomonique, aucune
autre forme clinique de laminopathie n’ayant été associée
à une mutation à ce site. Néanmoins, il faut savoir que les
patients qui en sont atteints peuvent présenter, en plus des
signes lipodystrophiques et des conséquences métabo-
liques qu’ils engendrent, une atteinte musculaire de sévé-
rité variable évoquant une dystrophie musculaire des
ceintures : faiblesse musculaire proximale, amyotrophie
des ceintures scapulaires et/ou pelviennes contrastant
avec l’hypertrophie musculaire des mollets et élévation
modérée des créatines phosphokinases (CPK). Des
troubles de la conduction cardiaque (bloc auriculoventri-
culaire) peuvent aussi se manifester (3).
Ces observations montrent la nécessité de rechercher
chez tout patient porteur d’une mutation LMNA, quel
qu’en soit le signe initial d’appel, les signes de chacune
des laminopathies. Le Holter-ECG, à la recherche de
troubles rythmiques ou conductifs cardiaques, est parti-
culièrement indispensable pour dépister et traiter d’éven-
tuelles atteintes infracliniques.
Certaines mutations des lamines A/C
peuvent conduire à des syndromes
lipodystrophiques moins typiques et plus
modérés que le syndrome de Dunnigan
Toutes les laminopathies décrites plus haut peuvent être
de sévérité variable, ou se présenter sous des formes
cliniques atypiques. Il en est ainsi pour certaines dystro-
phies musculaires, certaines neuropathies, ainsi que des
syndromes de vieillissement accéléré atypiques dits “pro-
géroïdes”.
De même, à côté de la forme caricaturale du syndrome de
Dunnigan décrite plus haut, il est important de noter qu’il
existe de nombreux phénotypes atypiques et modérés de
lipodystrophie de Dunnigan, parfois très proches du syn-
drome métabolique banal. Ainsi, l’équipe de S. O’Rahilly
a rapporté les observations de plusieurs patients porteurs
de mutations situées dans le domaine C-terminal de la
lamine A/C, mais n’affectant pas le codon 482, chez
lesquels la lipoatrophie des membres et surtout la lipo-
atrophie sous-cutanée abdominale sont beaucoup moins
sévères que dans la forme classique. De la même façon,
les troubles métaboliques, et en particulier l’hypertrigly-
céridémie, étaient beaucoup moins marqués chez ces
patients (11). Nous avons rapporté le cas d’une patiente
dont la laminopathie a été révélée par un syndrome des
ovaires polykystiques de forme sévère avec insulinorésis-
tance, mais sans lipodystrophie clinique (12).
La physiopathologie des laminopathies
reste mal connue
L’analyse des nombreux phénotypes décrits, et notam-
ment des formes mixtes, suggère l’existence d’un conti-
nuum pathologique au sein des laminopathies. Les ano-
malies cellulaires semblent aussi rapprocher ces
maladies, pourtant cliniquement éloignées. En effet, les
fibroblastes de patients atteints de lipodystrophie de Dun-
nigan, de dystrophie musculaire d’Emery-Dreifuss, de
dysplasie acromandibulaire ou de progéria présentent des
anomalies nucléaires similaires, à la fois morphologiques
et fonctionnelles, le pourcentage de cellules affectées
étant plus ou moins important selon la mutation (6, 10,
13). Deux principales hypothèses, non exhaustives, sont
actuellement avancées pour expliquer les laminopathies.
La première hypothèse est mécanique et suggère une fra-
gilité nucléaire accrue in vivo. Les lamines mutées entraî-
neraient une désorganisation du réseau de lamine, res-
ponsable d’une susceptibilité accrue des noyaux et des
cellules au stress mécanique. Cette hypothèse est confor-
tée par les études de fibroblastes de patients en culture
77
Métabolismes Hormones Diabètes et Nutrition (X), n° 2, mars/avril 2006
Mise au point
Mise au point

(13), ainsi que par l’étude des cellules fibroblastiques de
souris Lmna-/- qui montrent une plus grande sensibilité
nucléaire au stress mécanique par rapport à des cellules
fibroblastiques de souris sauvages (14). Cette hypothèse
physiopathologique mécanique expliquerait plus volon-
tiers les atteintes musculaires et cardiaques des lamino-
pathies, du fait des contraintes mécaniques importantes
engendrées par la contraction musculaire. De plus, les
mutations responsables des laminopathies musculaires
(squelettiques et cardiaques) ont la particularité d’affec-
ter la structure tridimensionnelle des lamines A/C, entraî-
nant ainsi une désorganisation du réseau de lamines et
une fragilisation du noyau. La seconde hypothèse phy-
siopathologique est celle de l’altération de la fonction de
certains gènes exprimés de façon tissu-spécifique par les
lamines mutées. La délocalisation et la fragmentation de
l’hétérochromatine observées dans des fibroblastes de
patients pourraient ainsi perturber le programme d’ex-
pression de certains gènes. Les mutations du gène LMNA
pourraient également altérer les interactions des lamines
A/C avec certains facteurs de transcription. Ainsi, la
mutation R482W, associée à la forme typique du syn-
drome de Dunnigan, affaiblit l’interaction de la lamine A
avec le facteur de transcription adipocytaire SREBP1 in
vitro, ce qui pourrait être à l’origine des troubles de la
différenciation adipocytaire et de la résistance à l’insu-
line observés dans les lipodystrophies (15). L’hypothèse
actuellement privilégiée pour expliquer les troubles
métaboliques est celle d’une dysfonction primitive du
tissu adipeux devenu atrophique, qui n’assurerait plus ni
ses fonctions métaboliques (stockage des triglycérides)
ni ses fonctions endocrines (sécrétion de leptine et
d’adiponectine, en particulier), conduisant à une insuli-
norésistance par excès de lipides dans les tissus non adi-
peux, foie et muscle en particulier (16). L’augmentation
du tissu adipeux intra-abdominal contribue aussi, de par
son activité lipolytique physiologiquement plus marquée
que celle du tissu sous-cutané, à l’afflux d’acides gras
libres au foie, qui active la néoglucogenèse et la synthèse
des VLDL. Cependant, d’autres hypothèses physiopa-
thologiques méritent d’être étudiées plus avant. En effet,
nous avons mis en évidence des anomalies primitives de
la transmission du signal insulinique dans les fibroblastes
d’une patiente atteinte de laminopathie avec insulino-
résistance, mais sans lipodystrophie clinique (12).
Concernant les syndromes de vieillissement accéléré, des
études récentes ont montré le rôle toxique de l’accumu-
lation nucléaire de la progérine, prélamine A tronquée
dont la maturation en lamine A est bloquée. Celle-ci agi-
rait de façon dominante-négative en perturbant la répa-
ration des lésions de l’ADN induites par des agents muta-
gènes (17). La progéria et les syndromes progéroïdes
seraient ainsi associés à une instabilité génomique.
Ces hypothèses physiopathologiques ne sont pas exclu-
sives, et des facteurs supplémentaires, génétiques et
acquis, modulent probablement les conséquences des
mutations des lamines A/C, comme en témoignent la
variabilité phénotypique intrafamiliale et la complexité
de certains phénotypes mixtes.
Éléments thérapeutiques
Dans la lipodystrophie de Dunnigan, le principal risque
à court terme est la pancréatite aiguë secondaire à une
poussée d’hypertriglycéridémie : la limitation de l’alcool,
des sucres à index glycémique élevé, et la maîtrise du
poids sont au premier plan des recommandations pour
l’éviter. Les patients doivent connaître les signes de pan-
créatite aiguë dont l’apparition doit les inciter à consul-
ter très rapidement. Les hypolipémiants, principalement
les fibrates, sont souvent indiqués. À long terme, il
convient de limiter les complications du diabète et le
risque cardiovasculaire, très préoccupant chez ces
patients. Aucun traitement spécifiquement adapté aux
laminopathies n’est actuellement disponible. Le diabète
est traité en priorité par les insulinosensibilisateurs, met-
formine et glitazones ; parfois, il nécessite de très fortes
doses d’insuline. La leptine, efficace à la fois sur le dia-
bète, la dyslipidémie, l’infiltration lipidique du foie et du
muscle dans les lipoatrophies généralisées, l’est proba-
blement aussi dans les lipodystrophies partielles, au
moins chez les patients clairement déficients en leptine,
mais seules les observations de quelques patients traités
ont été rapportées dans la littérature. Le problème de la
disponibilité du produit pour ces indications limitées est
majeur. Enfin, la stéatose hépatique peut aussi bénéficier
des insulinosensibilisateurs et de la leptine. L’effet de ces
traitements sur la fonction ovarienne n’a pas été étudié
dans la lipodystrophie de Dunnigan.
Conclusion
La lipodystrophie familiale partielle de Dunnigan est
caractérisée par une lipoatrophie sous-cutanée post-
pubertaire des membres et du tronc, épargnant la région
cervicofaciale, associée aux troubles métaboliques habi-
tuels des lipoatrophies : troubles de la tolérance au glu-
cose avec insulinorésistance (mise en évidence par une
hyperinsulinémie à jeun, mais surtout postprandiale ou à
deux heures d’une hyperglycémie provoquée par voie
orale), hypertriglycéridémie, et également stéatose hépa-
tique et syndrome des ovaires polykystiques. Si cette
forme caricaturale est assez facile à évoquer clinique-
ment chez les femmes, en raison de la lipoatrophie mar-
quée qui exacerbe les reliefs musculaires, elle est plus
difficile à reconnaître chez les hommes. De plus, l’exis-
tence de phénotypes lipodystrophiques très atténués
illustre la difficulté du dépistage de ces laminopathies
78
Métabolismes Hormones Diabètes et Nutrition (X), n° 2, mars/avril 2006
Mise au point
Mise au point
 6
6
1
/
6
100%