Chaire internationale M. Pierre Magistretti, professeur associé L

Chaire internationale
M. Pierre M, professeur associé
L’enseignement dispensé au cours de l’année académique 2007-2008, dans le
cadre de la Chaire internationale, intitulé : « Cellules gliales, neuroénergétique et
maladies neuropsychiatriques » a été centré sur les mécanismes cellulaires et
moléculaires du métabolisme énergétique cérébral et sur le rôle que les cellules
gliales jouent dans ces processus en condition physiologiques et pathologiques.
Outre l’enseignement ex-cathedra, un colloque, d’une journée, a été organisé en fin
de cours, intitulé : « Neurosciences et psychanalyse : une rencontre autour de
l’émergence de la singularité ».
Fondements de la neuroénergétique
Le cours a débuté par la définition d’un certain nombre de concepts fondamentaux
de la neuroénergétique. La neuroénergétique est un terme dérivé de celui de
bioénergétique et qui se réfère aux mécanismes moléculaires et cellulaires de la
production et de la consommation d’énergie qui sont directement liés à l’activité
neuronale. En fait, la neuroénergétique représente l’ensemble des processus
énergétiques qui sont liés au traitement de l’information, au sens large du terme,
par le système nerveux. Le cerveau est un organe qui a d’importantes demandes
énergétiques. En effet, bien que ne représentant que 2 % du poids corporel total,
son activité rend compte de 20 à 25 % de la consommation d’énergie totale de
l’organisme. La question qui se pose donc est celle de savoir quels sont les
mécanismes propres au cerveau qui requièrent ces demandes importantes d’énergie ?
Pour répondre à cette question, le premier cours s’est focalisé sur ce que l’on appelle
le budget énergétique du cerveau et, en particulier, du cortex cérébral. Etant donné
que 85 % des synapses et des neurones présents dans le cortex utilisent le glutamate
comme neurotransmetteur, différents auteurs ont proposé de calculer le coût
énergétique de la transmission glutamatergique dans le cortex cérébral [1]. Ainsi, si
l’on prend en considération les différents processus moléculaires liés à la

804 PIERRE MAGISTRETTI
neurotransmission glutamatergique, tels que les potentiels d’action, la libération
présynaptique, la recapture et le recyclage par les astrocytes périsynaptiques et
l’action postsynaptique, les chiffres suivants ont été calculés. Pour recycler le
glutamate libéré par 4 000 vésicules, ce recyclage impliquant la transformation du
glutamate en glutamine par l’astrocyte ainsi que sa métabolisation en alpha-
cetoglutarate et en aspartate, 11 000 molécules d’ATP sont nécessaires. Au niveau
postsynaptique la libération d’une vésicule de glutamate active environ 15 à
50 canaux non-NMDA ayant un temps d’ouverture moyen de 1 à 1,5 msec
(millisecondes) et une capacitance d’environ 12 pS (picosiemens). En considérant
une force électrochimique d’environ 120 mV, il ressort un coût d’environ
67 000 molécules d’ATP par vésicule de glutamate. Pour ce qui est des récepteurs
NMDA, ce coût est de 70 000 molécules d’ATP et de 3 000 pour les récepteurs
métabotropes. Le maintien des potentiels de repos au niveau des neurones est estimé
à 3,5 × 108 molécules d’ATP par seconde et au niveau astrocytaire 108 molécules
d’ATP par seconde. Ramené à un coût par vésicule de glutamate libérée, la
transmission glutamatergique, la signalisation pré et postsynaptique combinée au
recyclage astrocytaire du glutamate est estimée à 1,6 × 105 molécules d’ATP par
vésicule libérée. Pour ce qui est de la genèse et de la propagation du potentiel
d’action, le coût énergétique est estimé à 3,98 molécules d’ATP. Dans la mesure où
un potentiel d’action peut évoquer la libération de glutamate à partir d’environ
8 000 vésicules synaptique et en considérant une fréquence de 4 Hz, on arrive à un
coût global de 3,3 × 108 molécules d’ATP. Si l’on ajoute à ces coûts la consommation
liée aux effets post-synaptiques on aboutit à un coût global de 7 × 108 molécules
d’ATP par neurone par potentiel d’action. En intégrant ces coûts pour une
fréquence de décharge à 4 Hz la consommation globale serait de 3,3 × 109 molécules
d’ATP par neurone par seconde. Avec une densité au niveau cortical d’environ
9,2 × 107 neurones par cm3, donc par gramme [2], on calcule une consommation
globale d’énergie par la matière grise de 30 à 40 ATP/mmol/g/min. Cette valeur
correspond bien à celle mesurée par la technique du 2-déoxyglucose [3], avec
laquelle on obtient des valeurs de 30 à 50 mmol/g/min. Pour ce qui est des différents
processus liés à la neurotransmission glutamatergique, leur contribution relative se
répartirait de la manière suivante : 47 % pour les potentiels d’action, 35 % pour les
réponses postsynaptiques, 12 % pour le maintien des potentiels de repos et des
gradients électrochimiques, 3 % pour le recyclage glial du glutamate et 3 % pour
l’activité de libération à partir des terminaisons [1]. Si l’on met en relation cette
consommation liée à la transmission glutamatergique avec la consommation globale
d’énergie par le cortex cérébral, il en résulte une consommation d’environ 15 % qui
serait déterminée par des mécanismes autres que la transmission glutamatergique,
notamment par des processus de fonctionnement commun à toutes les cellules de
l’organisme. En résumé, il apparaît que la transmission glutamatergique constitue
environ 85 % du coût énergétique cérébral. Des calculs analogues ont été effectués
chez le primate, en prenant en compte la densité synaptique, le nombre de neurones
par mm3, les fréquences de décharge et ont abouti à une estimation d’un coût

CHAIRE INTERNATIONALE 805
énergétique de 2,5 × 109 molécules d’ATP par neurone par potentiel d’action, ce
qui correspond à peu près à un coût de 2,5 fois inférieur à celui déterminé chez le
rongeur [4].
Le couplage métabolique neurone-glie
Ayant déterminé quels sont les processus liés à l’activité neuronale qui
consomment de l’énergie, le cours a abordé l’étude des mécanismes qui sont à la
base du couplage entre l’activité neuronale et la consommation d’énergie. En effet,
une des questions encore aujourd’hui ouvertes en neurobiologie et en
neuroénergétique spécifiquement, est celle de savoir comment les événements
électrochimiques qui se produisent au niveau neuronal et, en particulier, au niveau
synaptique, se traduisent par une augmentation de la disponibilité de substrats
énergétiques localement en lien direct avec l’activité neuronale. Dans cette partie
du cours, les travaux du laboratoire ont été présentés. Ces travaux ont permis de
mettre en évidence un rôle central d’un type particulier de cellules gliales dans ce
couplage métabolique. En effet, les astrocytes ont une disposition morphologique
particulière, possédant des processus qui entourent, en grande partie, les profils
synaptiques et d’autres qui recouvrent les parois des capillaires intraparenchymateux.
Ces derniers processus périvasculaires sont appelés les pieds astrocytaires. Au
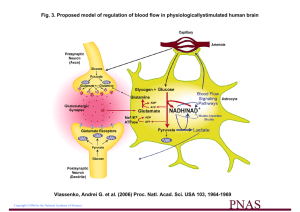
laboratoire, nous avons démontré que le glutamate libéré présynaptiquement est
recapté, de manière très efficace, par les astrocytes au travers de transporteurs
spécifiques dénommés EAAC1 et EAAC2 qui utilisent le gradient électrochimique
du sodium comme force électrochimique pour transporter le glutamate à l’intérieur
de l’astrocyte contre son gradient chimique. Cette entrée de sodium active la
sodium/potassium-ATPase qui en consommant de l’ATP en diminue la disponibilité
et donc active comme, par un mécanisme homéostatique, l’entrée de glucose dans
l’astrocyte. De manière surprenante, le glucose recapté par ce mécanisme est
relargué sous forme de lactate qui peut être consommé par le neurone après
conversion en pyruvate. Le pyruvate peut intégrer le cycle de Krebs et produire par
la phosphorylation oxydative à laquelle il est couplé 17 ATP par molécule [5].
La navette lactate astrocyte-neurone
Les différents éléments moléculaires de cette « navette lactate astrocyte-neurones »
ont été caractérisés. Ainsi, les transporteurs au monocarboxylate (MCT) qui
permettent le transfert intercellulaire du lactate sont sélectivement exprimés :
MCT1 au niveau astrocytaire et MCT2 au niveau neuronal. De plus, l’expression
de l’enzyme lactate deshydrogénase (LDH) présente aussi une distribution cellulaire
sélective. Ainsi la forme LDH1, forme qui est exprimée dans des tissus et cellules
qui utilisent le lactate comme substrat comme, par exemple le myocarde, est
sélectivement exprimée au niveau neuronal alors que la forme LDH5, qui elle est
exprimée dans les tissus glycolytiques produisant du lactate, sont exprimés de
manière sélective au niveau des astrocytes. Ainsi il semble exister un mécanisme
direct de couplage entre l’activité synaptique et la consommation de glucose qui

806 PIERRE MAGISTRETTI
met en jeu les astrocytes, le recaptage de glutamate par ces cellules et la production
de lactate à partir de glucose importé depuis les capillaires, qui peut ensuite être
utilisé comme substrat énergétique par les neurones [6].
L’utilisation de souris chez lesquelles le gène codant pour le transporteur du
glutamate glial a été invalidé a démontré clairement, qu’en l’absence de cette
molécule, le couplage entre l’activité synaptique glutamatergique et l’utilisation de
glucose n’a pas lieu [7]. Des expériences conduites par l’utilisation d’oligonucléotides
antisens ciblés contre le transporteur au glutamate glial ont donné des résultats
analogues [8]. Les expériences ont été conduites dans les deux cas dans la voie
somato-sensorielle qui connecte les vibrisses aux barrils.
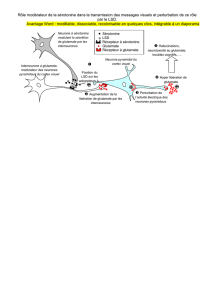
Le coût énergétique de la neurotransmission inhibitrice
La question qui a été ensuite abordée dans le cours est celle du coût énergétique
de la transmission inhibitrice. En effet, environ 10 % des synapses corticales sont
GABAergiques. Les résultats démontrent toutefois que le GABA, bien que recapté
par l’astrocyte, ne modifie pas, de manière suffisante, l’homéostasie sodique, le
signal principal pour l’activation de la sodium/potassium-ATPase et la réponse
métabolique qui lui est couplée. Les augmentations de sodium induites par le
recaptage de GABA sont marginales avec une cinétique lente qui n’aboutit pas à
une activation rapide de la sodium/potassium-ATPase. Le GABA n’active donc pas
la glycolyse astrocytaire. L’absence d’effet métabolique du GABA au niveau de
l’astrocyte soulève la question du coût énergétique de la transmission inhibitrice et
des mécanismes de couplage pour faire face à ces besoins. L’organisation synaptique
des neurones GABAergiques fournit une piste de réflexion. En effet, la grande
majorité de ces neurones sont des interneurones, notamment au niveau du cortex
cérébral. Ces interneurones GABAergiques reçoivent eux-mêmes des afférences
glutamatergiques. Une explication possible dès lors est que lors de la libération de
glutamate dans une région corticale, l’entrée de glucose dans le parenchyme
médié par la transmission glutamatergique fournit suffisamment d’énergie
localement pour également faire face aux besoins énergétiques des interneurones
GABAergiques.
Ce point de vue est d’ailleurs conforté par les expériences conduites au laboratoire
qui ont démontré que le signal glutamatergique est amplifié du point de vue
spatial par le biais des jonctions communicantes (gap junctions) qui existent entre
les astrocytes. En effet, le glutamate stimule la production d’une vague calcique
qui se propage de proche en proche entre les astrocytes, notamment par le biais
des jonctions communicantes ; divers laboratoires on démontré que cette vague
calcique stimule la libération locale de glutamate à partir de l’astrocyte [9]. Le
glutamate ainsi libéré à partir d’astrocytes est recapté par les astrocytes adjacents
produisant, comme cela pouvait être prévu, une entrée de sodium et une propagation
d’une vague sodique. Cette même vague sodique déclenche par les mécanismes
décrits précédemment, l’entrée de glucose et produit donc une vague métabolique.

CHAIRE INTERNATIONALE 807
Ainsi, suite à l’activation métabolique localisée produite par la libération synaptique
de glutamate, le couplage qui aboutit à l’entrée de glucose localement, est amplifié
par l’existence de cette vague métabolique produite par la libération de glutamate
par les astrocytes. Ainsi ce mécanisme augmente considérablement le volume
cortical au sein duquel le glucose est importé en réponse à l’activation
synaptique [10]. Cette amplification du signal métabolique permet également de
fournir les substrats énergétiques aux interneurones GABAergiques qui ne semblent
pas avoir de mécanisme de couplage neurométabolique direct.
Le lactate comme substrat énergétique pour l’activité neuronale
L’utilisation de lactate comme substrat énergétique a également été discutée. En
effet, par des expériences de résonance magnétique par spectroscopie (MRS) il a
été possible de démontrer que les neurones, en présence de concentrations égales
de lactate et de glucose, consomment de manière préférentielle le lactate, dans un
rapport de 9 à 1 [11]. Dès lors, il semble que le lactate soit, non seulement un
substrat utilisable par les neurones mais, qu’en fait, il s’agirait d’un substrat
préférentiel.
Kasischke et collaborateurs [12], ont analysé par microscopie biphotonique le
signal NADH/NAD+ comme marqueur de la glycolyse (augmentation du signal)
ou de la phosphorylation oxydative (baisse de NADH), lors de l’activité synaptique.
Ces expériences ont permis d’apporter des informations sur la cinétique et la
séquence des processus qui constituent la navette lactate astrocyte neurone. D’après
ces expériences, suite à une activation neuronale, il existe une utilisation rapide de
lactate et son oxydation par les neurones. À cette première phase, illustrée par une
diminution du signal NADH localisée sélectivement au niveau neuronal, suit une
réponse glycolytique marquée par l’augmentation du signal NADH et qui est
exclusivement localisé au niveau astrocytaire. Ainsi, il semble que lors de l’activation,
les neurones utilisent rapidement les substrats énergétiques disponibles dans
l’espace extracellulaire, vraisemblablement du lactate et que le mécanisme médié
par le transporteur au glutamate reconstitue ce pool extracellulaire de lactate pour
les utilisations subséquentes [13].
La question de l’utilisation du lactate de manière préférentielle par les neurones
a ensuite été abordée à la lumière de données bien établies de la biochimie ainsi
que de données récentes fournies par la résonance magnétique spectroscopique.
Ainsi, le lactate peut être utilisé sans aucun investissement d’ATP, contrairement
au glucose, par une simple conversion en pyruvate sous l’action de la lactate
déshydrogénase. Il apparaît dès lors que l’utilisation de ce substrat qui ne comporte
pas investissement d’énergie, est avantageuse du point de vue énergétique.
Lactate et transfert d’équivalents réducteurs
D’autre part, le lactate est transporté à travers les membranes via les transporteurs
en monocarboxylate par un mécanisme de co-transport avec des protons, donc
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%