L`anatomie du coeur - Faculté des Sciences Oujda

Université Mohammed
Premier
Faculté Des Sciences
Département De Biologie
Oujda, Maroc
Année universitaire
2009 – 2010
www.sciences1.ump.ma
FILIERE SCIENCES DE LA VIE
Module de Physiologie Animale
Semestre 5
Physiologie
Animale
CHAPITRE III
PHYSIOLOGIE DU CŒUR ET
DES VAISSEAUX
Professeurs.
Hassane MEKHFI
Abdelkhaleq LEGSSYER

1. Introduction
Le système circulatoire assure la circulation
du sang à travers toutes les parties du corps.
Sa fonction principale est d’assurer les
échanges des nutriments et des produits
métaboliques entre les capillaires sanguins et
le milieu interstitiel entourant les cellules.
Le système circulatoire est formé par le cœur
et les vaisseaux sanguins. Il est organisé en
circuit fermé composé de deux parties :
circuit pulmonaire appelé petite circulation
chargée d'oxygéner le sang et circuit
systémique appelé grande circulation chargée
de distribuer le sang oxygéné à tout le corps
(figure 1).
2. Cœur
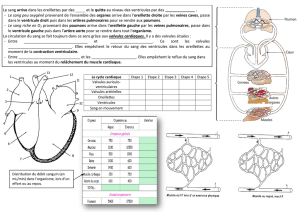
2.1. Anatomie du cœur
2.1.1. Schéma anatomique
Le cœur est un organe formé essentiellement
d'un muscle strié appelé myocarde. Il est entouré
d'un "sac" séreux appelé péricarde et tapissé à
l'intérieur par une fine membrane appelée
endocarde.
Le cœur des mammifères comprend quatre
cavités : deux oreillettes et deux ventricules. Les
cavités droite et gauche sont totalement séparées
par une cloison appelée septum.
Ces cavités sont reliées à des vaisseaux sanguins
qui ramènent le sang vers le cœur appelés veines,
et des vaisseaux qui transportent le sang vers les
organes et tissus du corps, appelés artères.
Veines : il y a deux veines caves (veine cave
inférieure et veine cave supérieure) qui
ramènent le sang de tout le corps vers
l’oreillette droite. Il y a aussi quatre veines
pulmonaires qui ramènent le sang des
poumons vers l’oreillette gauche.
Artères : Il y a deux grandes artères : l’artère
pulmonaire qui transporte le sang vers les
poumons et l’artère aorte qui transporte le
sang vers tous les tissus et organes du corps.
Figure 2 : Schéma anatomique du cœur
Les ventricules
Le ventricule gauche est divisé en cinq parties : la
pointe appelée apex, le septum qui sépare les
deux ventricules, le mur inférieur sur lequel
repose le cœur dans le corps, le mur latéral et le
mur antérieur situé vers l'avant, au voisinage des
côtes (figure 3).
Les valvules mitrales et tricuspides sont fixées au
myocarde par des cordons tendineux liés à des
muscles papillaires. Leur ouverture ne peut se
faire que dans un seul sens : des oreillettes vers
les ventricules, et déterminent ainsi le sens de
circulation du sang (figure 3). Le ventricule
gauche est plus puissant que le ventricule droit.
Le muscle du ventricule gauche est nettement
plus épais que celui du ventricule droit.
Cœur
Aorte
Veine cave
Circuit
pulmonaire
Circuit
systémique
Figure 1 : Schéma anatomique du système
circulatoire.
Physiologie du cœur et des
vaisseaux
Artère aorte
Veines
pulmonaires
Artère pulmonaire
Artère aorte
Veine cave
inférieure
Veine cave
inférieure
Valvules
mitrales
Valvules
tricuspides

Figure 3 : Valvules et paroi cardiaque
2.1.2. Vascularisation du cœur
La paroi du cœur est irriguée par deux artères
appelées artères coronaires (figure 4). Ces artères
forment un réseau vasculaire très dense. Elles
prennent naissance au niveau de l’artère aorte
juste après les valvules aortique.
2.1.3. Tissu automatique et tissu
conducteur du cœur
Le cœur est un organe automatique. Cet
automatisme est assuré par la présence au niveau
de l’oreillette droite d’un tissu automatique
appelé tissu pacemaker localisé au niveau du
nœud sinusal. On le trouve également au niveau
d’un autre nœud appelé auriculo-ventriculaire
localisé au niveau de la jonction entre les
oreillettes et les ventricules.
Le tissu conducteur débute par le faisceau de His
qui est relié au nœud auriculo-ventriculaire. Il se
termine par le réseau de Purkinje (figure 5). Le
rôle de ce tissu est d’assurer la conduction
électrique dans les deux ventricules.
2.1.4. Innervation du cœur
Le cœur est innervé par le système nerveux
autonome sympathique et parasympathique. Le
parasympatique véhiculé par le nerf pneumo-
gastrique (appelé aussi nerf vague ou nerf X)
innerve uniquement le nœud sinusal. Le
sympathique par contre innerve l’ensemble du
cœur : nœud sinusal et myocarde (figure 5).
Figure 4 : vaisseaux coronaires
Figure 5 : Tissu automatique et innervation du
cœur

2.2. Electrophysiologie
cardiaque
Le muscle cardiaque est formé par des cellules
musculaires striées appelées cardiomyocytes. Les
cardiomyocytes ont une forme en Y et possèdent
un seul noyau (figure 6). Elles sont reliées entre
elles au niveau de zones spécialisées appelées
disques intercalaires. A ce niveau se trouvent des
« gap junction » ou jonctions lâches ou encore
jonctions à trous qui permettent un couplage
électrique entre les cellules voisines. Le
myocarde fonctionne ainsi comme un syncytium.
2.2.1. Transports membranaires des
cardiomyocytes
La membrane plasmique des cardiomyocytes
possède plusieurs systèmes de transports
ioniques, on distingue (figure 7) :
- (1) des canaux de type VOC : des canaux
sodiques, calciques, potassiques et chlores.
- (2) des canaux de type ROC : principalement
un canal potassique lié à un récepteur
muscarinique ACh
- (3) des transports actifs primaires : pompe
Ca2+, pompe Na-K, pompe H+
- (4) un système d’échange Na-Ca
Rôle des différents transports
Canaux VOC : Les canaux VOC interviennent
dans la naissance de l’activité électrique
(potentiel d’action PA) des cardiomyocytes. On
distingue deux courants dépolarisants et deux
courants repolarisants :
- courant sodique : dépolarisation rapide
- courant calcique dépolarisation lente
- courant chlore : repolarisation rapide
- courant potassique : repolarisation lente
Canaux ROC : interviennent dans la régulation
neurohormonale de l’activité cardiaque (voir plus
moins).
Pompe Na-K : maintient un gradient chimique de
Na+ et de K+. Le Na+ étant plus concentré à
l’extérieur et le K+ plus concentré à l’intérieur de
la cellule. Cette pompe transporte 3Na+ contre
2K+, elle est donc électrogène et de ce fait
participe aussi dans l’activité électrique de la
cellule.
Pompe Ca2+ : maintient une concentration de
Ca2+ intracellulaire très basse (de l’ordre de
0,1µM).
Pompe H+ : empêche l’acidification du milieu
intracellulaire.
2.2.2. Potentiel d’action du muscle
cardiaque
Na+ Ca2+ Cl- K+ K+
3Na+ 2K+ Ca2+ H+ Ca2+3Na+
VOC
ROC
R
ATP
ADP
ATP
ATP
ADP
ADP
Figure 7 : Transports membranaires d’un
cardiomyocyte
4
3
1
2
cardiomyocyte
disques intercalaires
Figure 6 : Cellules musculaires cardiaques

Le PA des cardiomyocytes est caractérisé par sa
durée très longue (300 ms) par rapport au PA du
muscle squelettique (2 ms). Cette durée est liée à
la présence d’une phase de plateau due à un
courant dépolarisant retardé, le courant calcique
(ICa). Comme le montre la figure 8A, le PA des
cardiomyocytes est composé de 5 phases notées
de 0 à 4.
Phase 0 : potentiel de repos, il est stable et sa
valeur est comprise entre –90 mV et –
80 mV. Cette phase est due à une
perméabilité potassique dominante
appelée courant potassique de base IK1.
Phase 1 : dépolarisation rapide due au courant
sodique INa qui ramène le potentiel de
membrane (Em) à des valeurs de
l’ordre de +20mV.
Phase 2 : repolarisation rapide due à un courant
chlore ICl qui repolarise le Em vers
0mV.
Phase 3 : appelée aussi phase de plateau qui
maintient la dépolarisation à 0 mV
pendant une durée de 150 ms à peu
près. Cette phase est due au courant
calcique ICa.
Phase 4 : repolarisation retardée due au courant
potassique IK.
2.2.3. Automatisme cardiaque
L’automatisme cardiaque est lié à l’existence de
cellules automatiques appelées cellules
pacemaker localisées au niveau du nœud sinusal.
Ces cellules présentent une activité électrique
spontanée c’est à dire qui déclenche un PA sans
excitation externe. Cet automatisme est dû à la
présence d’un potentiel de repos instable. En
effet il y a une pente de dépolarisation
diastolique due à un phénomène très complexe
qui fait intervenir plusieurs canaux ioniques.
Cette pente de dépolarisation ramène le potentiel
de repos au seuil de potentiel, ce qui déclenche
l’ouverture des canaux calciques de type VOC et
la naissance d’un PA de type calcique. Ce PA est
caractérisé par (figure 9) :
- un potentiel de repos de l’ordre de – 60 mV (1)
- une pente de dépolarisation diastolique (2)
- une phase de dépolarisation plus lente que celle
du PA du myocarde (3).
Le PA qui prend naissance au niveau du nœud
sinusal se propage dans les deux oreillettes puis
atteint le nœud auriculo-ventriculaire. A partir de
ce nœud, le PA se propage par le tissu conducteur
formé par le faisceau de His puis le réseau de
Purkinje vers les deux ventricules. La propagation
du PA vers les ventricules commence par l’apex
du cœur puis remonte vers le haut des deux
ventricules.
Remarque : il y une barrière entre les oreillettes
et les ventricules qui empêche la propagation
directe du PA des oreillettes vers les ventricules.
Le seul endroit où s’effectue cette propagation est
le nœud auriculo-ventriculaire et le tissu
conducteur.
2.2.4. Electrocardiogramme ECG
Les courants ioniques qui naissent au niveau du
cœur se propagent dans tout le corps et peuvent
être enregistrés à la surface en plaçant des
électrodes à différents endroits (bras droit, bras
gauche et jambe gauche). Le signal enregistré
représente une ddp de surface et s’appèle ECG ou
électrocardiogramme (figure 10).
L’onde P correspond à la dépolarisation des
oreillettes
3
- 60 mV
seuil
-90
+20
0
Em mV
4
3
2
1
0
0
300
Temps ms
A
Figure 9 : PA et contraction du muscle
cardiaque
PA
Contraction
B
1
2
Figure 9 : PA des cellules du nœud sinusal
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%